|
|
Температура кипения сталиТаблица температуры плавления (tпл) металлов и сплавов при нормальном атмосферном давлении
Вернуться в раздел аналитики Запись опубликована автором admin в рубрике Полезные материалы. Добавьте в закладки постоянную ссылку.Металлы температуры кипения - Справочник химика 21Металл Температура кипения, Металл Температу за кипения, [c.388]Достаточно высокие температуры кипения и низкие температуры замерзания спиртов дают возможность применять их в широком диапазоне температур эксплуатации. Спирты, как и углеводороды, отличаются незначительной коррозионной активностью по отношению к металлам. Поэтому баки и топливную аппаратуру двигателя изготовляют из обычных доступных и недорогих материалов. Хорошие эксплуатационные свойства, относительно низкая температура горения, высокая устойчивость горения и хорошая охлаждающая способность обусловили выбор спиртов в качестве горючих в ранний период развития жидкостных ракетных двигателей. Спирты как ракетное горючее не потеряли своего значения до настоящего времени. [c.122] Поэтому, если содержание общей серы в дизельных топливах и керосинах не превышает 0,5 %, а в бензинах - 0,2 %, то за рубежом используют экономичные процессы окислительной демеркаптанизации. Возможна также очистка бензинов и с более высоким содержанием общей серы в тех случаях, если доля демеркаптанизированного бензина в товарном продукте будет сравнительно невысока. Это связано с тем, что в процессе окислительной демеркаптанизации общее содержание серы в топливах не снижается, а происходит лишь перевод меркаптанов в дисульфиды. Дисульфиды в отличие от меркаптанов инертны по отношению к металлам, имеют более высокую температуру кипения, т.е. менее летучи, являются ингибиторами окисления [15,52]. [c.20] Я Нужен металл с низкой температурой плавления и высокой температурой кипения (тогда не будет паров — это хорошо). Свинец или олово. Нет, пары свинца ядовиты. Значит — олово. [c.81] Железо представляет собой твердый светло-серебристый металл, пластичный, легко поддающийся ковке, прокатке, штампованию и волочению. Временное сопротивление на разрыв составляет 170—210 МПа. Плотность железа 7,87 т/м , температура плавления 1539°С, температура кипения 3200°С. Многие свойства железа существенно зависят от его чистоты. [c.39] Особое внимание при работе с комплексными гидридами металлов уделяется подбору растворителя. Здесь решающее значение имеют устойчивость комплексных гидридов металлов, температура кипения растворителя (в том случае, если реакция требует нагревания), а также растворимость исходных соединений (табл. 2.3). [c.118] Содержание воды в фреоне-22 не должно превышать 0,0025%. Технические масла растворяет частично. Инертен к металлам. Температура кипения при атмосферном давлении 40,8° С. Давление в конденсаторе обычно не превышает 12 кгс/сж . Температура замерзания —160° С. [c.17] Для проверки термометров могут быть использованы химически чистые жидкости и металлы, температуры кипения и плавления которых приводятся в справочной литературе. Проверка термометра по точкам плавления или затвердевания чистых металлов может быть выполнена так, как указано в гл. 36 и 37. [c.183] Температура кипения и летучесть. Температура кипения иридия выше температуры кипения рутения, но ниже, чем определено для осмия. Как и для этих двух металлов, температуру кипения иридия нельзя считать точно установленной. Приводимые в различных источниках цифровые значения этой величины для иридия указывают, что она должна лежать между 4800 и-4900° С. [c.681] Перечисленные методы непригодны, если вещества разлагаются при температурах разделения, когда примеси конденсируются вместе с основным веществом в одной и той же температурной зоне. В таких случаях прибегают к дистилляции с водяным паром, к варьированию давления в системе (от 1—2 мм рт. ст. до десятков атмосфер), к испарению в вакууме при температуре ниже точки кипения. Последний способ — молекулярная дистилляция — применяется для очистки термически малостойких органических веществ, а также металлов, температура кипения которых высока. [c.47] Однако в дальнейшем необходимо следующее создать более укрупненные установки на основе комбинирования смежных и связанных процессов обеспечить высокий отбор от потенциала светлых нефтепродуктов и масляных дистиллятов заданного фракционного состава (без налегания соседних фракций по температурам кипения) значительно снизить удельные расходы (на 1 т перерабатываемой нефти) топлива, электроэнергии, воды, воздуха, реагентов (щелочь, деэмульгатор, антикоррозионные средства), металла уменьшить стоимость строительства и сократить эксплуатационные расходы. [c.231] Некоторые физические свойства переходных металлов (температуры плавления и кипения, а также твердость) обусловлены числом имеющихся в их атомах неспаренных -электронов. Эти свойства постепенно усиливаются, достигая максимума в группе Мп, а затем с юза уменьшаются с увеличением порядкового номера элементов. [c.450] Сырьем служит металлический цинк удельная масса 6,9— 7,2 кг/м , температура плавления 419,4 °С, температура кипения 930 °С, теплота плавления 125,1 кДж и теплота испарения 1624 кДж. Нагретый выше 900 °С цинк сгорает зеленоватым пламенем в окись-цинка. Металл, полученный металлургическим методом (марки не ниже Ц-3), содержит 98,7% цинка и до 1,3% примесей (1% свинца и до 0,2% кадмия). Металл, полученный электролитическим способом (марки Ц-0, Ц-1 и Ц-2), содержит до 99,9% цинка и не более 0,1% примесей. Содержание свинца в таком цинке не превышает 0,05% и кадмия 0,02%. [c.149] В форме порфириновых комплексов моннефтях ванадия и никеля [784, 785]. Вследствие летучести порфирины попадают в заметных количествах уже во фракции с начальной температурой кипения около. 300°, обусловливая тем самым присутствие в них ванадия [786]. С точки зрения нефтедобычи и нефтепереработки представляют интерес поверхностно-активные свойства порфиринов как соединений, влияющих на образование и устойчивость водонефтяных эмульсий [787, 788]. Эти свойства могут играть также определенную роль в процессе формирования состава нефтей, обеспечивая перенос металлов пз водной среды в нефтяную. По составу нефтяных порфириновых фрагментов можно судить о физико-химических условиях и процессах, протекающих при формировании нефтяных систем, кроме того, при миграции нефтей происходит направлен-пое фракционирование порфиринов вследствие неодинаковой сорбции на породах молекул различной полярности. Это позволяет использовать информацию о составе порфиринов для решения ряда задач нефтяной геологии [789—791]. [c.140] В табл. 6 для ряда величин приведены значения, рассчитанные на оспове-экстраполяции экспериментальных данных, а также значения, зависящие в той или другой степени от результатов использования приближенных закономерностей. Это относится в особенности к температурам кипения высококипящих металлов и к параметрам процесса испарения при этих температурах. Экстраполяция охватывала нередко значительные интервалы температур. Данные разных авторов часто существенно расходятся. [c.343] Несколько отличается от этого процесса способ, предложенный в работе [244] по получению алкилароматических углеводородов. Дегидрирование н-парафинов проводят при температуре 400—600 °С в присутствии водорода. В качестве катализатора используют соединения металлов VIH группы (Pt или Pd), осажденные на оксиде алюминия, и в присутствии оксида лития. В качестве сырья для получения олефинов предложено использовать фракцию бензина с температурой кипения 150— 250 °С. Присутствующие в сырье парафиновые углеводороды с разветвленной цепью предварительно отделяют с использованием цеолитов (например, цеолита 5А). [c.260] Оптимум по содержанию дегидрирующего металла, обусловливающий максимальную активность катализатора, обеспечивает оптимум и по содержанию непредельных углеводородов в реакционной смеси. Имеются работы, подтверждающие резкое увеличение начальной скорости крекинга парафиновых углеводородов при добавлении в них олефинов и наличие определенного оптимума. В работе [253] показано, что в присутствии олефинового углеводорода в 4 раза ускоряется начальная скорость крекинга парафинового углеводорода. Существует оптимум по давлению олефи-на, сильно зависящий от температуры кипения. Так, для 399 и 482 °С он равен соответственно 15 и 20%. С увеличением количества олефинов скорость крекинга насыщенных углеводородов уменьшается, так как непредельные углеводороды адсорбируются на активных центрах катализатора с большей скоростью, чем насыщенные углеводороды. [c.175] Благородные металлы обладают высокой коррозионной стойкостью в растворах кислоты любой концентрации до температуры кипения. [c.848] Масла для гидравлических систем должны иметь низкую температуру застывания (на 5—10 °С ниже температуры окружающего воздуха, при которой работает гидросистема), иметь температуры кипения на 20—30 °С выше максимальной рабочей температуры, обладать небольшой вязкостью, не вызывать коррозию металлов, не разрушать резиновых уплотнений, не содержать механических примесей. [c.247] Алюминий — твердый серебристо-серый металл. Легко поддается ковке, прокатке, волочению и резанию. Пластичность алюминия возрастает с повышением его чистоты. Плотность алюминия 2,7 т/м , температура плавления 660,2°С, температура кипения 2520°С. В расплавленном состоянии жидкотекуч и легко поддается литью. [c.15] Уксусная кислота слабая. Константа ее диссоциации 1,75-10 . Образует многочисленные растворимые в воде соли (ацетаты) и этерифицируется спиртами с получением сложных эфиров. Уксусная кислота обладает высокой коррозионной активностью по отношению ко многим металлам, особенно в парах и при температуре кипения, что необходимо учитывать при выборе материалов для аппаратуры. В ледяной кислоте стойки как на холоду, так и при температуре кипения, алюминий, кремнистый и хромистый чугуны, некоторые сорта нержавеющей стали, но разрушается медь. Техническая уксусная кислота обладает большей коррозионной активностью, которая усиливается в контакте с воздухом. Из неметаллических материалов стойки по отношению к уксусной кислоте специальные сорта керамики и эмали, кислотоупорные цементы и бетоны и некоторые виды полимерных материалов (полихлорвиниловые и фенолальдегидные пластмассы). Ингибитор коррозии в растворах уксусной кислоты — перманганат калия. [c.309] Разработаны и частично применяются системы, позволяющие вводить и выводить катализатор в процессе работы установки. Это частично решает вопрос о борьбе с загрязнением катализатора металлами и тяжелыми коксовыми отложениями. Катализатор используют в виде гранул размером 0,8. мм, вводимых и выводимых через соответствующие штуцера, или в виде тонкодисперсного порошка, суспендированного вначале в жидком сырье, затем в продукте. В другом варианте процесса сырье и водород вводят в реактор снизу — в кипящий слой катализатора. Автор [ 87] указывает, что расход водорода составляет 1—2 моль на 1 моль сырья. Последнее подтверждается наблюдениями, согласно которым в каждой большой молекуле сырья содержится атом серы. Большая часть углеводородов с меньшей температурой кипения, по-видимому, образуется при гидрообессеривании нефтяных остатков в результате удаления атомов серы или азота, соединяющих две или больше углеводородные группы, а не разрыва связей С— С. [c.257] И вот, в 1986—1987 гг. учеными ряда стран были получены уникальные оксидные материалы, которые, подобно металлам, характеризуются низким сопротивлением при комнатной температуре, но обладают сверхпроводимостью уже при 90—100 К И это, по-видимому, далеко не предел. Важность этого открытия заключается в том, что состояние сверхпроводимости в уже синтезированных материалах может быть технически реализовано при температуре кипения жидкого азота —= 77,3 К. Для понимания масштабов открывающихся перед наукой и техникой возможностей приведем две цифры среднее содержание азота в воздухе составляет 78,1% по объему, а гелия — 4,6-10 %. Кроме того, работа криогенных установок для получения жидкого азота, функционирующих при температурах около 70 К, обходится намного дешевле, чем работа аналогичной аппаратуры для получения жидкого гелия (Г О К). [c.5] Помимо рассмотренных типов связи, особо выделяют металлическую связь, которая проявляется при взаимодействии атомов элементов, имеющих избыток свободных валентных орбиталей по отношению к числу валентных электронов. При сближении таких атомов, например в результате конденсации пара, электроны приобретают способность свободно перемеш,аться между ядрами в пространстве именно благодаря относительно высокой концентрации свободных орбиталей. В результате этого в решетке металлов возникают свободные электроны (электронный газ), которые непрерывно перемещаются между положительными ионами, электростатически их притягивают и обеспечивают стабильность решетки металлов. Таков механизм образования металлической связи у непереходных металлов. У переходных металлов механизм ее образования несколько усложняется часть валентных электронов оказывается локализованной, осуществляя направленные ковалентные связи между соседними атомами. Поскольку ковалентная связь более прочная, чем металлическая, у переходных металлов температуры плавления и кипения выше, чем у щелочных и щелочноземельных металлов, а также у переходных металлов с электронными оболочками, близкими к завершению. Это наглядно видно при сопоставлении температур плавления и кипения металлов 6-го периода (табл. 10). [c.37] Упругость паров и температура кипения. Испаряемость бария становится заметной с 950°, Температура кипения бария при атмосферном давлении экспериментально определена равной 1537 , тогда как подсчитанная из уравненил упругости пара металла температура кипения лежит при 1696° [24]. [c.161] Реакционносиособный хлор-атом хлористого металлила реагирует в присутствии карбонила иикеля, давая хлористый никель и диметаллил (2,5-ди-метилгексадиеи-1,5) с температурой кипения 114,3° [51 [c.172] Дифтордихлорметан Ср2С1з фреон-12)— жидкость с температурой кипения 29,8 °С. Не ядовит, н реагирует при комнатной температуре с металлами. При его испарении поглощается большое количество теплоты. Применяется (как и другие ф р е о н ы — полифторхлоруглеводороды) в холодильных устройствах, а также как растворитель для образования аэрозолей. [c.479] Промышленных методов очистки газов от h3S и Oj весьма много. Из них наибольший интерес представляет очистка этанол-аминами, позволяюп ая при некоторых условиях совместить удаление h3S, СО2 и Н2О. Кроме этаноламиновой очистки для этой цели применяется водная промывка и очистка водными растворами карбонатов щелочных металлов. Этаноламиновая очистка углеводородных газов от HjS и СО 2 была разработана еще в 1930 г. Сейчас этот метод широко применяется в разных вариантах при подготовке сырья для нефтехимического синтеза. При очистке природных газов применяется водный раствор моноэтаноламина концентрацией 15— 20%. Помимо низкой стоимости моноэтаполамин характеризуется высокой реакционной способностью, стабильностью и легкостью регенерации. Температура кипения моноэтаноламина 170° С, он неограниченно растворяется в воде. [c.161] При низких температурах эти металлы покрыты защитной пленкой оксида и поэтому оказываются более инертными, чем можно судить по их окислительным потенциалам. У верхнего представителя этой группы оксид УзОд обладает амфотерными свойствами, подобно Т102. Он растворим и в кислотах, и в основаниях, образуя при этом сложные полимеры с плохо различимыми свойствами. В состоянии окисления +4 ванадий также образует соединения, которые проявляют свойства, промежуточные между ионными и ковалентными УС14-молекулярная жидкость с температурой кипения 154 С. В отличие от этого соединения У(П1) имеют ионный характер. [c.441] Символ 2п голубовато-белый металл мягкий, ломкий, однако при температурах от 100 до 150 °С легко тянется и вальцуется выше 205 °С снова становится ломким. На воздухе устойчив, поскольку покрывается тонкой оксидной пленкой, предохраняющей металл от дальнейшего окисления. При нагревании до температуры кипения сгорает ярким голубовато-белым плa eнeм с образованием белого дыма оксида цинка неустойчив по отношению к водяным парам реагирует с кислотами с образованием солей и выделением водорода. [c.168] Термодинамическая характеристика процессов йена рения для различных металлов и химических соединений мояч ет быть получена пз диаграмм зависимости равновесного давления паров от температуры. По этим диаграммам могут быть определены температуры кипения металлов и их соединений при давлении 10 Па, а также равновесные давления пара для различных температур. [c.8] Для высококипящих металлов наряду с определением температур кипения экстраполяцией данных по давлению пара, полученных при более низких температурах, применяется и другой путь, основанный на экстраполяции величи 0 . — Яд каждой из фаз и определении температуры, при которой разность между ними становится равной нулю. Приходится с некоторой осторожностью относиться к применению этого пути для определения температур кипения высококипящих металлов при допущении, что пары состоят из одноатомных молекул, если реальный молекулярный состав пара неизвестен. [c.343] Имеются сведения о возникновении в тантале при действии иа него водорода хрупких разрушений вследствие наводорожи-вания металла, в особенности при нагреве. По этой причине не рекомендуется контактировать тантал с другими металлами, процесс коррозии которых протекает с водородной деполяризацией. На рис. 198 показано влияние температуры на растворимость водорода в тантале. Тантал становится также хрупким в серной кислоте при температуре кипения и концентрации 79% и в концентрированной соляной кислоте при 190" С. [c.293] Высокая концентрация сильнокислотных центров при их достаточно равномерном распределении, а также возможность достижения высокой степени диспергирования металлов обусловили ряд преимуществ цеолитных катализаторов ГК. Повышенная активность и стойкость к отравляющему действию сероводорода и аммиака дает возможность снизить температуру и давление водорода в процессе ГК и получать бензин с более высоким октановым числом, а также гарантирует большую продолжительность межрегенерационных пробегов даже при переработке сырья с повышенной температурой кипения. Использование цеолитных катализаторов в процессах ГК, направленных на максимальное производство бензина, позволяет перейти от двухступенчатой схемы к квазиодноступенчатой, т. е. исключить стадию фракционирования после первой ступени (рис. .12). [c.113] Измерение и регулирование температуры. Для измерения температуры у нас в стране применяют термодинамическую и стоградусную щкалу. Нуль стоградусной щкалы соответствует температуре плавления льда при давлении 760 мм рт. ст., а 100 °С— температуре кипения воды при том же давлении. Измерение температуры основано на физических явлениях, происходящих при нагревании тел, — возникновении электродвижущей силы в месте спая двух разнородных проводников. Два спаянных конца проволоки из различных металлов называют термопарой. Величина электродвижущей силы термопары зависит от температуры спаянного конца. Электрический ток термопар является постоянным, поэтому один из ее свободных концов имеет положительный потенциал, а другой — отрицательный. Свободные концы термопар соединяют проводами, а затем с измерительным прибором. Действие прибора основано на компенсации электродвижущей силы термопары противоположно направленной разностью потенциалов, создаваемой током от батареи, включенной в цепь термопары. [c.87] Подробный обзор о лабораторной перегонке иод вакуумом металлов и сплавов, не содержащих железа, приведен в работе Шпендлеве [116]. Хорслей [117] описал аппаратуру для разгонки щелочных металлов. В соответствии с этими работами металл расплавляют в вакууме, фильтруют и затем перегоняют преимущественно ири давлении до 10" мм рт. ст. Пары металла конденсируют в конденсаторе, охлаждаемом циркулирующим маслом. Для получения чистого тантала Паркер и Вильсон [118] использовали хлорид тантала ТаС ., (температура кипения 240° С при 760 мм рт. ст.). Безобразов с сотр. [118а] разработал кварцевый аппарат диаметром 40 мм и высотой разделяющей части 1250 мм для аналитической перегонки высококипящих веществ с температурой кипения до 1000°С (сера, селен, теллур, цинк, кадмий, сульфид мышьяка и др.). [c.260] С>и1женные газы при изоэнтальпическом снижении давления (дросселировании) охлаждаются до низких температур. Жидкая фаза, попадая на окружающие предметы, интенсивно испаригтся и охлаждает их (например, температура кипения пропана —42°С, бутана —0,6°С), при этом отрицательные тем-ператуэы газов не зависят от температуры окружающего воздуха. Низкие отрицательные температуры вызывают опасное воздействие на материалы металлы становятся хладноломкими (хрупкими) и могут разрушаться прн обычной механической нагрузке прокладки делаются ломкими н т. п. Поэтому при использовании сжиженных газов весьма важен выбор конструкционных материалов для оборудования и арматуры, в частно ти ограничивается применение чугунной арматуры. [c.253] К физическим взрывам следует отнести также явление так называемой физической (или термической) детонации. Это явление возникает при смешении горячей и холодной жидкостей, когда температура одной из них значительно превышает температуру кипения другой (например, при выливании расплавленного металла в воду). В образовавшейся парожидкостной смеси испарение может протекать взрывным образом вследствие развивающихся процессов тонкой фрагментации капель расплава, быстрого теплоотвода от них и перегрева холодной жидкости. Физическая детонация сопровождается возникновением ударной волны с избыточным давлением в жидкой фазе, достигающим в некоторых случаях тысяч атмосфер. Указанное явление может стать причиной крупных аварий в ядерных реакторах и на промышленных предприятиях металлургической, химической и бумажной промышленности ( ronenberg, 1980]. - Прим. ред. [c.244] Сырьем каталитического крекинга может быть любая фракция нефти с температурой кипения выше 200° С. Чаще всего используют ди- 0,2 стиллятные фракции. Недистил-лятные фракции повышают выход кокса и содержат следы металлов, отравляющие ката.лизатор. [c.245] К высокомолекулярным соединениям нефти мы относим вещества молекулярного веса выше 400, независимо от того, имеют ли они чисто углеводородную природу или в состав их входят гетероатомы (кислород, сера, азот, металлы и т. д.). Вещества эти содержатся в тяжелой части нефти, имеющей температуру кипения выше 350° С [11. Самые большие молекулы веществ, входящих в состав нефтей, имеют молекулярный вес, в пределах от 3000 до 5000. Возможность наличия в нефтях более высокомолекулярных соедийений маловероятна. Наиболее высокомолекулярными соединениями нефти являются, ио-видимому, асфальтены Е литературе встречаются данные о тТШ —что асфальтены характеризуются молекулярными весами от 20 ООО до 200 ООО [2]. Однако эти высокие значения молекулярный вй С О асфальтенов, приводимые в работах отдельных исследователей, объясняются тем, что они не учитывают явления ассоциации молекул асфальтенов, которое наблюдается даже в разбавленных растворах при температурах ниже. 60—70° С. [c.12]
Температура плавления меди – при какой температуре плавится медьБлагодаря тому, что температура плавления меди достаточно невысокая, этот металл стал одним из первых, которые древние люди начали использовать для изготовления различных инструментов, посуды, украшений и оружия. Самородки меди или медную руду можно было расплавить на костре, что, собственно, и делали наши далекие предки. Этап плавления меди Несмотря на активное применение человечеством с древних времен, медь не является самым распространенным природным металлом. В этом отношении она значительно уступает остальным элементам и занимает в их ряду только 23-е место. Как плавили медь наши предкиБлагодаря невысокой температуре плавления меди, составляющей 1083 градуса Цельсия, наши далекие предки не только успешно получали из руды чистый металл, но и изготавливали различные сплавы на его основе. Чтобы получить такие сплавы, медь нагревали и доводили до жидкого расплавленного состояния. Затем в такой расплав просто добавляли олово или выполняли его восстановление на поверхности расплавленной меди, для чего использовалась оловосодержащая руда (касситерит). По такой технологии получали бронзу – сплав, обладающий высокой прочностью, который использовали для изготовления оружия. Какие процессы происходят при плавлении медиЧто характерно, температуры плавления меди и сплавов, полученных на ее основе, отличаются. При добавлении в медь олова, имеющего меньшую температуру плавления, получают бронзу с температурой плавления 930–1140 градусов Цельсия. А сплав меди с цинком (латунь) плавится при 900–10500 Цельсия. Во всех металлах в процессе плавления происходят одинаковые процессы. При получении достаточного количества теплоты при нагревании кристаллическая решетка металла начинает разрушаться. В тот момент, когда он переходит в расплавленное состояние, его температура не повышается, хотя процесс передачи ему теплоты при помощи нагрева не прекращается. Температура металла начинает вновь повышаться только тогда, когда он весь перейдет в расплавленное состояние. Диаграмма состояния системы хром-медь При охлаждении происходит противоположный процесс: сначала температура резко снижается, затем на некоторое время останавливается на постоянной отметке. После того, как весь металл перейдет в твердую фазу, температура снова начинает снижаться до полного его остывания. Как плавление, так и обратная кристаллизация меди, связаны с параметром удельной теплоты. Данный параметр характеризует удельное количество теплоты, которая требуется для того, чтобы перевести металл из твердого состояния в жидкое. При кристаллизации металла такой параметр характеризует количество теплоты, которое он отдает при остывании. Более подробно узнать о плавлении меди помогает фазовая диаграмма, показывающая зависимость состояния металла от температуры. Такие диаграммы, которые можно составить для любых металлов, помогают изучать их свойства, определять температуры, при которых они кардинально меняют свои свойства и текущее состояние. Кроме температуры плавления, у меди есть и температура кипения, при которой расплавленный металл начинает выделять пузырьки, наполненные газом. На самом деле никакого кипения меди не происходит, просто этот процесс внешне очень его напоминает. Довести до такого состояния ее можно, если нагреть до температуры 2560 градусов. Как понятно из всего вышесказанного, именно невысокую температуру плавления меди можно назвать одной из основных причин того, что сегодня мы можем использовать этот металл, обладающий многими уникальными характеристиками. Углерод Температура плавления - Энциклопедия по машиностроению XXLСвариваемость стали зависит от содержания в ней углерода. С увеличением содержания углерода температура плавления стали понижается, и ее легче пережечь. Так как при газовой сварке зона нагрева металла больше, чем при электросварке, то для большинства деталей автомобиля, изготовленных из среднеуглеродистых термически обработанных и специальных сталей, применяют электросварку. [c.278]Автомобильные детали, изготовленные из малоуглеродистых и среднеуглеродистых сталей, хорощо свариваются газовой сваркой. Труднее сваривать газовым пламенем стали с содержанием углеродов более 0,4%, термически обработанные и легированные стали. Это связано с тем, что с повышением содержания углерода температура плавления углеродистой стали понижается и пламенем газовой горелки легко ее пережечь. [c.117] По мере насыщения железа углеродом температура плавления его понижается и в распаре и заплечиках основная масса железа расплавляется. Полученный железоуглеродистый сплав капельками стекает в горн и, протекая по кускам кокса, дополнительно насыщается углеродом (3,9—4,0% и более) и серой, а также растворяет кремний, марганец, фосфор и другие примеси, которые восстанавливаются из руды. [c.36] Цементит (Ц) - химическое соединение железа с углеродом (карбид железа Ре,С). В цементите содержится 6,67% углерода. Температура плавления цементита около 1600 С. Он очень тверд (НВ-800), хрупок и практически не обладает пластичностью. Цементит неустойчив и в определенных условиях распадается, выделяя свободный углерод в виде графита по реакции Ре,С->ЗРе+С. [c.27] Обычными примесями в техническом никеле являются кобальт, железо, кремний, медь. Эти примеси не оказывают вредного влияния, так как образуют с никелем твердые растворы. При содержании углерода свыше 0,4% но границам зерен выделяется графит, что вызывает снижение прочности металла. Сера является вредной примесью, образующей с никелем сульфид N 382, который дает с никелем эвтектику с температурой плавления 625°С. Кислород, присутствующий в металле в виде NiO, при малом его содержании не сказывается на свойствах металла. [c.256] Углерод является неметаллическим элементом 1Ь периода 4-й Группы (атомный номер 6) удельный вес 25,0 т/м температура плавления 3500° С. [c.58] Углерод - неметаллический элемент П периода IV 1-руппы периодической системы, атомный номер 6, атомная масса 12, атомный радиус 0,077 нм, плотность 2,5 г/см . Температура плавления 3500 °С [36]. [c.66] С углеродом вольфрам образует карбиды W2 (с температурой плавления 2780°С) и W (который при 2600°С разлагается на графит и W2 ). Карбиды вольфрама используют в производстве твердых сплавов для изготовления режущих инструментов. [c.95] Большая часть асимметричных молекул органических веществ содержит асимметричный элемент — атом углерода, связанный четырьмя валентными связями с различными радикалами, Две такие формы — оптические антиподы — показаны на рис. 20.6. Зеркальные изомеры вещества имеют, как правило, одинаковые химические свойства, плотность, температуру плавления и т. д. Основное их специфическое свойство — оптическая активность, когда правые и левые формы вращают плоскость поляризации в разных направлениях. Это единственный надежный и точный метод исследования разных форм асимметричных веществ. [c.77] Однако в некоторых случаях с увеличением содержания углерода и хрома в сталях при высокой температуре могут возникать обратные эффекты, когда величины 6] и /11 (0) увеличиваются вследствие снижения температуры плавления. В результате сопротивление деформации высокоуглеродистых сталей при низкой скорости выше, чем низкоуглеродистой стали. Последнее хорошо известно пз заводского опыта. [c.473] Железо может находиться в двух аллотропических формах, которым соответствуют решетки ОЦК и ГЦК (см. рис. 1.4). Если чистое железо претерпевает аллотропическое превращение ОЦК ГЦК,. т. е. a-Fe ч у-Ре при 911 °С, то при сплавлении с углеродом эта температура может снизиться вплоть до 727 °С (рис. 1.12, линия PSK). Температура плавления железа составляет 1539 °С. [c.23] Хром, молибден и вольфрам при 20 °С устойчивы при повышенных температурах они окисляются, особенно молибден и вольфрам, оксиды которых летучи. При высокой температуре эти металлы реагируют с азотом и углеродом их карбиды имеют высокие твердость и температуру плавления. [c.111] Технологические данные. Литейные свойства сплава хорошие. Сплав хорошо модифицируется перегревом до температуры 850—900 С и введением веществ, содержащих углерод. При плавлении сплав МЛ6 требует применения флюсов (Ви2, ВиЗ), предупреждающих горение. Температура литья 690—800° С. Жидкотекучесть по длине прутка 335 мм. Горячеломкость по ширине кольца 25—30 мм. Линейная усадка 1,1—1,2%. [c.152] ВОЛЬФРАМ Физические свойства В табл. 2 приведены физические свойства вольфрама. Металл отличается высокой температурой плавления, превосходящей температуру плавления всех элементов, кроме углерода, низкой упругостью пара, малой скоростью испа- 2. Физические свойства вольфрама и молибдена [c.447] Молибден относится к наиболее тугоплавким элементам. По температуре плавления его превосходят только четыре элемента вольфрам, рений, тантал и углерод. [c.456] Точка перехода железа из жидкого состояния в твёрдое и обратно лежит при температуре 1539° С. В зависимости от концентрации углерода температура плавления изменяется по линии AB D (линия ликвидуса), имея минимум в эвтектической точке С (содержание углерода 4,Зо/о). [c.89] Карбид железа РвдС хорошо растворяется в твердом железе и постепенно образуется сплав железа с углеродом. С увеличением содержания углерода температура плавления сплава значительно понижается и достигает минимального значения 1147° С при 4,3% С. В зонах печи с высокими температурами — обычно в нижней части шахты — начинается плавление сплава. Жидкий сплав — чугун, стекая вниз, омывает куски раскаленного кокса и дополнительно интенсивно науглероживается. В нем также растворяются восстановленный марганец, кремний и другие примеси. Конечный состав чугуна устанавливается в горне. При этом большое значение имеют состав, свойства и количество шлака. [c.31] Цементит — карбид железа РСдС, образующийся при содержании углерода 6,67%. Цементит имеет сложную орторомбическую решетку, в элементарной ячейке которой находятся 12 атомов железа и 4 атома углерода. Температура плавления цементита около 1600° С. Цементит обладает очень высокой,твердостью —800 НВ, хрупкий. До 217° С обладает слабыми ферромагнитными свойствами. [c.155] Карбиды Химичес- кая формула Практическое содеожание углерода, % Температура плавления, С Твердость по шкале Мооса Удель- ный вес Размер частиц после размола, мк [c.468] При насыщении углеродом температура плавления железа понижается и на уровне распара и заплечиков оно расплавляется. Капли железоуглеродистого сплава, протекая по кускам кокса, дополнительно насыщаются углеродом (до 4% и более), марганцем, кремнием, фосфором, которые восстанавливаются из руды, а также серой, содержащейся в коксе. Эти процессьх протекают следующим образом. [c.38] Углерод. С повышением содержапия углерода температура плавления стали понижается при содержании углерода 0,7% и вьнпе кислородная резка стали затрудняется. Кроме того, при содержании углерода свыше 0,3% обработанная поверхность заметно увеличивает свою твердость по сравнению с первоначальной. Это явление поверхностной закалки выражается тем резче, чем выше содержание углерода и скорость охлаждения изделия после резки. При содержании углерода свыше 0,7% в случае резки без иредварительного подогрева изделия необходимо более мощное подогревающее пламя для нагрева стали до температуры, при которой она. может гореть в кислороде. [c.322] Цементит (Ц) — карбид железа F g в котором содержится 6,67 % углерода. Температура плавления цементита 1252 °С. Обладает очень высокой твердостью (около 800 НВ), легко царапает стекло. Цементит очень хрупок, имеет почти нулевую пластичность, имеет сложную ромбическую решетку с плотной упаковкой атомов. При нагреве цементит распадается. [c.119] Всем этим требованиям удовлетворяют железо, углеродистые и низколегированные конструкционные стали при невысоком содержании углерода температура плавления железа 1535 °С, горения 1200 °С, температура плавления оксида железа — 1370 °С. Тепловой эффект реакций окисления достаточно высок Ре + + 0,50г = РеО + 64,3 ккал/г-моль, ЗРе + 20а = Рез04 + Н- 266,9 ккал/г моль, 2Ре + 1,50г = РезОд + 198,5 ккал/г-моль, а теплопроводность железа является ограниченной. [c.399] Хром но отношению к кислороду обладает несколько большим сродством, чем железо, и образует окисел СгаО с высокой температурой плавления. Хром также обладает большим сродством к углероду, чем железо, и является карбидообразующим элементом. Он может входить в состав карбидов типа ] емептпт (Fo, Сг)зС и образует карбиды типов СГ7С3 и СггзС [иногда с частичной заменой атомов хрома другими, в частности железа, например (Fe, Сг)2зС(). Карбиды хрома термически более стойкие по срав-иению с карбидом железа, они растворяются медленнее и при более высоких температурах. В связи с этим для гомогенизации твердых растворов Fe—Сг—С требуется более высокая температура (рис. 128) и более длительная выдержка, чем для углеродистых сталей (- 900° С). [c.258] Наибольшее внимание привлекают алюминиевые сплавы, армированные волокнами из бора, углерода, нержавеющей стали и бериллия титановые сплавы, армированные волокнами молибдена и бериллия, и никелевые сплавы, армированные волокнами вольфрама, молибдена и их сплавов. Данные о прочности некоторых волокон и армированных материалов приведены в табл. 156 и 157. Такие материалы наиболее перспективны для деталей, работающих в условиях, близких к одноосному растяжению, например лопаток турбин я компрессоров. Максимальные рабочие температуры этих материалов близки к температуре плавления матрицы. На рис. 465 в качестве примера показаны температурные зависимости прочности для алюминия, армированного стеклянными и кварцевыми волокнами. Для сравнения на графике приведены свойства дисперсноупроч ненного алюминия и алюминиевого сплава. На рис. 466 показана макро- и микроструктура прутка из сплава нихром, армированного волокнами вольфрама (50%). [c.640] Опускаясь, шихта достигает зоны в печи, где температура 1000— 1100 С. При этих температурах восстановленное из руды твердое железо, взаимодействуя с оксидом углерода, коксом и сажистым углеродом, интенсивно растворяет углерод, вследствие чего температура плавления железа понижается и на уровне распара и заплечиков оио расплавляется. Капли железоуглеродистого сплава, протекая по кускам кокса, насыщаются углеродом (до 4 % и более), марганцем, кремнием, фосфором, которые при температуре 1000— 1200 С восстанавливаются из руды, а также серой, содержащейся в jiOK e. [c.26] Второму и четвертому условию не удовлетворяет чугун. По мере повышения содержания углерода в железе процесс резки значительно ухудшается из-за снижения температуры плавления и повышения температуры воспламенения. Чугун, содержапшй более 1,7% углерода, кислородной резкой не обрабатывается. Кроме того, вязкость шлака значительно возрастает при увеличении содержания кремния, который обязательно содержится в чугуне, что также является одной из причин невозможности вести кислородную резку чугуна. [c.103] В железо-углеродистых сплавах основными компонентами являются железо и углерод. Железо - металл IV периода VIII группы периодической системы. Атомный номер 26, атомная масса 55,85, атомный радиус 0,126 нм, плотность 0,126 г/смЗ. Температура плавления 1539 °С. [c.66] Углерод расположен в Периодической системе элементов Д.И. Менделеева под номером 6 и имеет температуру плавления 3900°С, кипения 4825°С, атомную массу 12,0115. Структура его гексагональная и типа алмаза, графита а = 0,356 нм г = 0,076 нм. Роль углерода при формировании физико-механических и эксплуатационных (износостойких, жаростойких) свойств жаропрочнЕ>1х отливок очень велика. [c.72] Температура плавления парафина повышается с увеличением содержания углерода. В процессе получения так называемого товарного парафина отделяют низкоплавкие парафины и масла. В соответствии с ГОСТ 13577-71 нефтяные парафины подразделяют на технические высокаочищеиные (марки Л и В), медицинский, технические очищенные (марки Г н Д) (ГОСТ 16960-71) и неочищенный (спичечный). Для модельных составов применяют очищенный технический белый парафин, содержащий не более 2,3% масла, поставляемый в виде плиток массой 8-12 кг. [c.174] Компонентами данной системы являются железо и углерод. Железо -металл серебристо-белого цвета, атомный номер 26, атомный вес 55,85, атомный радиус 1,27 температура плавления 1539 С, плотность 7,86 17См7 Железо обладает невысокой твердостью и прочностью НВ80, а, = 250 МПа, 5 = 50%, ф = 80% имеет три полиморфные модификации Fea, Fe-. и Fe [c.42] Углерод - неметатлический элемент, атомный номер 6, атомный радиус 0,77 А , атомный вес 12,01, температура плавления 3500 С, плотность 2,5 г/см7 Углерод полиморфен. Он может образовывать три кристатлофафи-ческие формы, графит, алмаз, фуллерен. [c.42] Графит — природный ископаемый кристаллический материал с содержанием углерода до 90% и выше с температурой плавления около 3900° С при свободном доступе кислорода и высокой температуре окисляется, давая в основном газообразные окислы СО и СО . Кристаллическая решетка графита имеет явно выраженную слоистую структуру, отличающуюся легким перемещением Слоев друг относительно друга. Твердость графита не велика и изменяется в зависимости от направления относительно кристаллографических осей решетки в 5 раз с лишним. Графит обладает крупнокристаллическим строением, что отличает его от мелкокристаллических углей, в частности от сажи, которая имеет особо мелкодисперсионное кр исталлическое строение. [c.264] Порошок бериллия окисляется быстро, а при повышении температуры бурно сгорает. С азотом бериллий реагирует при температуре выше 900 - С, образуя нитрид BejNa, а с углеродом вблизи температуры плавления образует карбид ВеаС. С водородом бериллий реагирует с трудом (в искровом разряде и т. п.К образуя гидрид. С аммиаком он реагирует легче, чем с азотом, образуя нитрид. Мелкодисперсный бериллий сгорает в парах серы, селена и теллура. [c.517] Температуры плавления и кипения химических элементов
Обозначения: (Т.Р. тройная точка). Литература: Bulletin of Alloy Phase Diagrams.
кипения, какая зависимость сопротивления, рекристаллизации, график Медные заготовки Сегодня медь является одним из самых востребованных металлов. Высокий спрос объясняется отличительными характеристиками, присущими этому металлу. Медь проводит электроток лучше любых других металлов, кроме серебра, благодаря этому ее используют в производстве кабелей и электропроводов. Температура плавления меди не высокая, металл пластичный и легко поддается обработке, благодаря этому качеству стало возможным ее применение в строительстве в качестве водопроводных тр. Этот металл имеет высокое сопротивление к внешним раздражающим факторам, поэтому долговечен и может быть использован несколько раз, после переплавки. Это качество меди высоко ценят экологи, поскольку при повторной обработке металла тратится значительно меньшее количество энергии, чем при добыче и обработки руды, к тому же сохраняются земные недра. Добыча медной руды не проходит бесследно, на месте отработанных рудников появляются токсичные озера, наиболее известное во всем мире такое озеро – Беркли-Пит в штате Монтана в США. Необходимая температура для плавления меди Медь не является легкоплавким металлом Люди нашли применение меди еще в древние времена, тогда ее добывали в виде самородков. Ввиду низкой температуры, необходимой для осуществления процесса плавления ее стали широко применять для изготовления орудий труда и охоты, самородки можно плавить на костре. В наши дни технология получения металла мало чем отличается от придуманной в древние времена, совершенствуются лишь печи, увеличена скорость обжига и объемы обработки. Здесь возникает уместный вопрос — какая температура плавления меди? Ответ на него можно найти в любом учебнике по физике и химии – медь начинает плавиться при температуре нагрева до 1083 оС.  Кипение меди уменьшает ее прочность В процессе термического воздействия на металл происходит разрушение его кристаллической решетки, это достигается при определенной температуре, которая в течение некоторого времени остается постоянной. В этот момент и происходит плавка металла. Когда процесс разрушения кристаллов полностью завершен, температура металла снова начинает подниматься, и он переходит в жидкую форму и начинает кипеть. Температура плавления меди значительно ниже, чем та, при которой металл кипит. Процесс кипения начинается с появлением пузырьков, по аналогии с водой. На этом этапе любой металл, в том числе и медь, начинает терять свои характеристики, в основном это отражается на прочности и упругости. Температура кипения меди составляет 2560 оС. Во время остывания металла происходит похожая картина, как и при нагреве – сначала температура опускается до определенного градуса, в этот момент происходит затвердевание, которое длится некоторое время, затем продолжается остывание до обычного состояния. Как изменяется металл под термическим воздействиемЛюбой нагрев меди влечет за собой изменение ее характеристик, наиболее значимой является величина ее удельного сопротивления. Медь является проводником электрического тока, при этом металл оказывает сопротивление движению носителям заряда. Отношение площади сечения проводника к оказываемому движению и называется удельным сопротивлением. Термо обработка медной трубы Так вот, эта величина для чистой меди составляет 0,0172 ОМ мм2/м при 20 оС. Этот показатель может измениться после термической обработки, а также вследствие добавления в состав различных примесей и добавок. Здесь наблюдается обратная зависимость сопротивления меди от температуры – чем выше была температура обработки металла, тем ниже будет ее сопротивление электрическому току. Для обеспечения наилучших электролитических характеристик медной проволоки, ее обрабатывают при 500 оС. Во время термической обработки можно не только придавать металлу нужную форму и размер, но и создавать различные сплавы. Самыми распространёнными медными сплавами является бронза и латунь. Бронза получается путем смешивания меди с оловом, а латунь – с цинком. Добавление алюминия и стали увеличивает прочность материала, а добавление никеля повышает антикоррозийные свойства. Но стоит заметить, что любая примесь снижает главное свойство – электропроводность, поэтому для изготовления жил электрокабеля используют чистый состав металла. Отжиг медиПод отжигом меди следует понимать процесс ее нагрева с целью дальнейшей обработки и приданию необходимых форм изделию. В ходе отжига металл становится более пластичным и мягким, поддающимся различным трансформациям. При отжиге меди температура достигает 550 оС, она приобретает темно-красный оттенок. После нагрева желательно быстро производить ковку и оправлять изделие на охлаждение.  Оджиг позволяет деформировать без повреждений любое изделие из меди Если подвергать материал медленному, естественному охлаждению, то возможно образование наклепа, поэтому чаще применяют мгновенное охлаждение путем помещения заготовки в холодную воду. Если превысить допустимую величину нагрева, металл может стать более хрупким и ломким. Во время отжига осуществляется процесс рекристаллизации меди, в ходе которого образуются новые зерна или кристаллы металла, которые не искажены решеткой и отделены от прежних зерен угловыми границами. Новые зерна по размеру могут сильно отличаться от предшественников, при их образовании высвобождается большое количество энергии, увеличивается плотность и появляется наклеп. Рекристаллизация осуществляется только после деформации изделия, и только после достижения ее определенного уровня. Для меди критический уровень деформации составляет 5%, если он не достигнут процесс формирования новых зерен не начнется. Температура рекристаллизации меди составляет 270 оС. Следует отметить, что при этой температуре процесс роста кристаллов только начинается, но он достаточно медленный, поэтому для достижения необходимого результата медь необходимо нагреть до 500 оС, тогда времени для остывания хватит для завершения процесса рекристаллизации. Видео: Плавление меди в микроволновкеТемпература плавления некоторых металлов, их сплавов и сталей в градусах Цельсия.Температура плавления некоторых металлов, их сплавов и сталей в градусах Цельсия.
Свойства некоторых твердых веществВ таблице ниже показаны основные свойства некоторых твердых веществ, такие как: точка плавления и точка кипения при 1013 гПа, а также плотность. Точки плавления и кипения твердых веществ также указаны в периодической таблице.
Комбинация гафния, углерода и азота. В правильных пропорциях такой сплав обладает замечательными теоретически свойствами. Ученые из Американского университета Брауна подсчитали, что температура плавления такого металла составит 4400 градусов по Кельвину, или 4126 градусов по Цельсию. Мостик в стиле оригами.Гениальное изобретение японских инженеровОбеспечение связи в регионах, пострадавших от стихийных бедствий, - сложная задача для служб: это нужно делать быстро, а природные условия ... подробнееЕсли можно создать такой сплав и он будет иметь желаемые свойства, то он будет наиболее устойчивым к плавлению веществом, известным человеку. Считается стойким, сталь плавится при температуре около 1500 градусов Цельсия, золото ок.1000 градусов по Цельсию, а алюминий всего 660 градусов по Цельсию. Ученые из Университета Род-Айленда использовали компьютерное моделирование для разработки новой формулы. Теперь они надеются синтезировать такой металл и подвергнуть его дальнейшим исследованиям. Более дешевый метод - Преимущество компьютерного моделирования в том, что различные комбинации могут быть дешево опробованы. Вместо того, чтобы искать в темноте, у нас есть шанс найти решение, о котором стоит позаботиться в лаборатории, - объяснил проф.Аксель ван де Валле из Университета Брауна. В настоящее время наиболее устойчивым к плавлению веществом является сплав гафния, тантала и углерода. Плавится при 3526 градусах Цельсия. Эти типы металлов в основном используются в тепловых экранах космических аппаратов и газовых турбинах. источник: ежедневная почта.co.uk # металл #Останавливаться #гафний # коричневый университет # азот #золото # алюминий .Температура плавления черной стали. Физические свойства, состав и характеристики металлического железаКаждый металл или сплав обладает уникальными свойствами, включая температуру плавления. В этом случае объект переходит из одного состояния в другое, в частном случае он становится жидким из твердого тела. Чтобы его растопить, необходимо приложить к нему тепло и нагреть до достижения желаемой температуры. При достижении необходимой температуры сплава он все еще может оставаться твердым.При постоянном воздействии начинает таять. Контакт Самая низкая точка плавления ртути - она плавится даже при -39 ° С, самая высокая у вольфрама - 3422 ° С. В случае сплавов (стали и др.) Определить точное число крайне сложно. Все зависит от соотношения их ингредиентов. Для сплавов он сохраняется как числовой интервал. Как работает этот процесс Когда нагревается , амплитуда тепловых колебаний молекул увеличивается. В сети появляются структурные дефекты , сопровождающиеся разрывом межатомных связей.Период разрушения сети и накопления дефектов называется плавлением. В зависимости от степени плавления металлов делятся на:
В зависимости от максимальной степени выбирается также расплавитель.Чем сильнее нагрев, тем он должен быть сильнее. Вторая важная величина - это степень кипения. Это параметр, при котором жидкость закипает. Обычно это в два раза выше точки плавления. Эти значения прямо пропорциональны друг другу и обычно даются при нормальном давлении. Если давление увеличивается, увеличивается и количество плавления. Если давление падает, оно падает. Таблица характеристик Чтобы найти этот параметр, необходимо просмотреть таблицу. Температуру кипения также можно найти в таблице. Среди элементов, наиболее часто используемых в быту, индексы температуры плавления следующие:
Как видно из этой части таблицы, наиболее легкоплавким металлом является ртуть, которая уже при положительных температурах находится в жидком состоянии. Температура кипения всех этих элементов почти в два раза, а иногда даже выше точки плавления. Например, для золота это 2660 ° C , алюминия - 2519 ° C , для железа - 2900 ° C, для меди - 2580 ° C, для ртути - 356,73 ° C .Для сплавов, таких как сталь, чугун и другие металлы, расчеты примерно такие же и зависят от соотношения компонентов в сплаве. Максимальная температура кипения металлов рений -5596 ° C ... Самая высокая точка кипения - это температура большинства огнеупоров. Существуют таблицы, в которых также указывается плотность металлов ... Самый легкий металл - литий, самый тяжелый - осмий. Осмий имеет более высокую плотность, чем уран и плутоний при комнатной температуре. К легким металлам относятся: магний, алюминий, титан. Самые популярные металлы - тяжелые: железо, медь, цинк, олово и многие другие. Последняя группа - это очень тяжелые металлы, в том числе вольфрам, золото, свинец и другие. Другой показатель, найденный в таблицах, - это теплопроводность металлов . ... Нептун - худший проводник тепла, а серебро - металл с лучшей теплопроводностью. Золото, сталь, железо, чугун и другие элементы находятся посередине между этими двумя крайностями. Яркие особенности каждого из них можно найти в соответствующей таблице. Температура плавления железа химической чистоты составляет 1539 o C. Железо технической чистоты, полученное в результате окислительного рафинирования, содержит определенное количество растворенного кислорода в металле.По этой причине его температура плавления падает до 1530 o C. Температура плавления стали всегда ниже точки плавления железа из-за наличия в ней примесей. Растворенные в железе металлы (Mn, Cr, Ni, Co, Mo, V и др.) Понижают температуру плавления металла на 1 - 3 ° C на 1% введенного элемента, а элементы из группы металлоидов (C, О, С, П и др.) При температуре 30-80 о С. На протяжении большей части общего времени плавления температура плавления металла изменяется в основном в результате изменений содержания углерода.При концентрации углерода 0,1 - 1,2%, которая типична для точной плавки на сталеплавильных агрегатах, температуру плавления металла с точностью, достаточной для практических целей, можно оценить по уравнению .Теплота плавления железа составляет 15200 Дж / моль или 271,7 кДж / кг. Температура кипения железа в публикациях последних лет приводится как 2735 o C. Однако опубликованы результаты исследований, согласно которым температура кипения железа намного выше (до 3230 o C). Теплота испарения железа составляет 352,5 кДж / моль или 6300 кДж / кг. Давление паров железа (Fe, Па) можно оценить по уравнению где Т - температура металла, К. Результаты расчетов давления насыщенных паров железа при различных температурах, а также содержания пыли в окислительной газовой фазе над металлом ( X , г / м 3) представлены в таблице 1.1. Таблица 1.1 - Давление насыщенных паров железа и газовая пыль при различных температурах
В соответствии с действующими санитарными нормами содержание пыли в газах, выбрасываемых в атмосферу, не должно превышать 0,1 г / м 3.Из данных таблицы 1.1 видно, что при 1600 o C содержание пыли в газах над открытой металлической поверхностью выше предельных значений. Поэтому необходимо очищать газы от пыли, в основном состоящей из оксидов железа. Вязкость динамическая ... Коэффициент динамической вязкости жидкости определяется из зависимости () где F - сила взаимодействия двух движущихся слоев, Н; S - площадь контакта слоев, м 2; - градиент скорости слоев жидкости по нормали к направлению потока, с -1. Динамическая вязкость сплавов железа обычно находится в диапазоне 0,001 - 0,005 Па · с. Ее значение зависит от температуры и содержания примесей, в основном углерода. Когда металл перегревается выше температуры плавления выше 25-30 ° C, температурный эффект незначителен. Кинематическая вязкость жидкости - это скорость передачи импульса на единицу массового расхода. Его значение определяется из уравнения .где - плотность жидкости, кг / м3. Величина динамической вязкости жидкого чугуна близка к 6-10-7 м 2 / с. Плотность железа при 1550 - 1650 о С составляет 6700 - 6800 кг / м3, при температуре кристаллизации плотность жидкого металла близка к 6850 кг / м3. Плотность твердого железа при температуре кристаллизации составляет 7450 кг / м3, при комнатной температуре - 7800 кг / м3. Из обычных примесей наибольшее влияние на плотность жидкого чугуна оказывают углерод и кремний, снижая ее. Поэтому обычный состав жидкого чугуна имеет плотность 6200 - 6400 кг / м3, твердого при комнатной температуре - 7000 - 7200 кг / м3. Плотность жидкой и твердой стали занимает промежуточное положение между плотностью чугуна и чугуна и составляет соответственно 6500-6600 и 7500-7600 кг / м3. Удельная теплоемкость жидкий металл практически не зависит от температуры. В предварительных расчетах его значение можно принять равным 0,88 кДж / (кг K) для чугуна и 0,84 кДж / (кг K) для стали. Поверхностное натяжение железа имеет максимальное значение при температуре около 1550 o C. В области более высоких и низких температур его значение уменьшается.Это отличает железо от большинства металлов, поверхностное натяжение которых уменьшается с повышением температуры. Поверхностное натяжение жидких сплавов железа сильно зависит от химического состава и температуры. Обычно он находится в диапазоне 1000 - 1800 мДж / м2 (рисунок 1.1). В котором кристаллическая решетка металла разрушается и переходит из твердого состояния в жидкое. Температура плавления металлов - это показатель температуры горячего металла, при которой начинается процесс (плавление).Сам процесс является обратной кристаллизацией и неразрывно с ней связан. Расплавить металл? он должен быть нагрет внешним источником тепла до температуры плавления, а затем продолжать подавать тепло для преодоления энергии фазового перехода. Дело в том, что значение температуры плавления металлов само по себе указывает температуру, при которой материал будет находиться в фазовом равновесии на границе раздела между жидкостью и твердым телом. При этой температуре чистый металл может существовать как в твердом, так и в жидком состоянии одновременно.Чтобы осуществить процесс плавления, необходимо перегреть металл немного выше равновесной температуры, чтобы получить положительный термодинамический потенциал. Придайте импульс этому процессу. Температура плавления металлов постоянна только для чистых веществ. Присутствие примесей сместит равновесный потенциал в ту или иную сторону. Это связано с тем, что металл с примесями образует другую кристаллическую решетку, и силы взаимодействия атомов в них будут отличаться от таковых в чистых материалах.В зависимости от значения температуры плавления металлы делятся на легкоплавкие (до 600 ° С, например, галлий, ртуть), среднетипкие (600-1600 ° С, медь, алюминий) и тугоплавкие (> 1600 ° С). C, вольфрам, молибден). В современном мире чистые металлы используются редко, поскольку они имеют ограниченный диапазон физических свойств. В промышленности давно и широко используются различные сочетания металлов - сплавов, разновидностей и свойств которых намного больше. Температура плавления металлов в различных сплавах также будет отличаться от точки плавления их сплава.Различные концентрации веществ определяют порядок их плавления или кристаллизации. Однако существуют равновесные концентрации, при которых металлы, составляющие сплав, затвердевают или плавятся одновременно, то есть ведут себя как однородный материал. Такие сплавы называют эвтектиками. Очень важно знать температуру плавления при работе с металлом, это значение необходимо как на производстве, для расчета параметров сплава, так и при эксплуатации металлических изделий, когда температура фазового перехода материала, из которого изготовлено изделие определяется ограничения в его применении.Для удобства эти данные сведены в единый металлический сплав - сводка результатов исследований физических свойств различных металлов. Также существуют аналогичные таблицы для сплавов. Температура плавления металлов также зависит от давления, поэтому данные в таблице актуальны для данного значения давления (обычно нормальные условия, когда давление составляет 101,325 кПа). Чем выше давление, тем выше температура плавления, и наоборот. В металлургической промышленности одним из основных направлений является литье металлов и их сплавов из-за невысокой стоимости и относительной простоты процесса.Вы можете отливать формы любых контуров и размеров, от маленьких до больших; подходит как для массового, так и для нестандартного производства. Литье - одна из старейших областей металлообработки, она берет свое начало примерно в бронзовом веке: 7–3 тысячелетии до нашей эры. мне. С тех пор было обнаружено множество материалов, что привело к развитию технологий и возросшим требованиям литейной промышленности. В настоящее время существует множество направлений и видов отливок, различающихся технологическим процессом.Одно остается неизменным - физическое свойство металлов переходить из твердого состояния в жидкое, и важно знать, при какой температуре начинают плавиться разные типы металлов и их сплавы. Процесс плавления металлаЭтот процесс представляет собой переход вещества из твердого состояния в жидкость. При достижении точки плавления металл может находиться как в твердом, так и в жидком состоянии, дальнейшее повышение приведет к полному переходу материала в жидкость. То же самое происходит во время затвердевания - при достижении точки плавления вещество начинает переходить из жидкого состояния в твердое, а температура не меняется до полной кристаллизации. Обратите внимание, что это правило применяется только к чистому металлу. Сплавы не имеют четкого температурного предела и проходят переход состояния к в некотором диапазоне :
Невозможно точно измерить температуру плавления таких веществ; точка перехода между состояниями указывает числовой диапазон. В зависимости от температуры, при которой начинается плавление металлов, обычно делят на :
Существует также точка кипения - точка, при которой расплавленный металл переходит в газообразное состояние.Это очень высокая температура, обычно вдвое превышающая точку плавления. Влияние давленияТемпература плавления и равная ей температура замерзания зависят от давления, которое увеличивается с увеличением давления. Это связано с тем, что при повышении давления атомы сближаются друг с другом и для разрушения кристаллической решетки их необходимо отодвинуть. При повышенном давлении требуется больше энергии теплового движения, и соответствующая температура плавления увеличивается. Есть исключения, когда температура, необходимая для разжижения, уменьшается с увеличением давления.Эти вещества включают лед, висмут, германий и сурьму. Таблица точек плавленияКаждый человек, занятый в металлургической промышленности, будь то сварщик, основатель, сталелитейный завод или ювелир, должен знать, при каких температурах плавятся материалы, с которыми они работают. В таблице ниже показаны температуры плавления наиболее распространенных веществ. Таблица температуры плавления Металлы и сплавы Помимо таблицы плавления существует множество других вспомогательных материалов.Например, ответ на вопрос, какова температура кипения железа, содержится в таблице кипения вещества. Помимо кипения, металлы обладают рядом других физических свойств, таких как прочность. Прочность металлов Существуют следующие группы: Прочность металла : 90 220Таблица прочности металла Самые популярные сплавы в повседневной жизни Таким образом, минимальная температура плавления ртути составляет -38,9 ° C, поэтому она уже жидкая при комнатной температуре. Этим объясняется тот факт, что у бытовых термометров нижняя граница -39 градусов по Цельсию: ниже этого показателя ртуть становится твердой. Припои, наиболее часто встречающиеся в быту, содержат значительный процент олова с температурой плавления 231,9 ° C, поэтому большинство припоев плавятся при рабочей температуре паяльника 250-400 ° C. сплавы с температурой плавления с более низкой температурой плавления, до 30 ° C, которые используются, когда перегрев паяемых материалов опасен. Для этих целей существуют припои с висмутом, причем плавление этих материалов находится в пределах 29,7 - 120 ° C. Плавление высокоуглеродистых материалов, в зависимости от компонентов сплава, находится в диапазоне от 1100 до 1500 ° C. Точки плавления металлов и их сплавов находятся в очень широком диапазоне температур, от очень низких температур ( ртуть) до предела в несколько тысяч градусов. Знание этих показателей, а также других физических свойств очень важно для людей, работающих в металлургической промышленности. Например, знание температуры плавления золота и других металлов будет полезно ювелирам, литейщикам и металлургическим заводам. Точка плавления металла - это минимальная температура, при которой он переходит из твердого состояния в жидкое. После плавления его объем практически не меняется. Металлы классифицируются по температуре плавления в зависимости от степени нагрева. Легкоплавкие металлыЛегкоплавкие металлы имеют температуру плавления ниже 600 ° С. Это цинк, олово, висмут. Такие металлы можно расплавить, нагревая их на плите или паяльником. Легкоплавкие металлы используются в электронике и машиностроении для соединения металлических компонентов и проводов, проводящих электрический ток.Температура составляет 232 градуса, а цинка - 419. Среднеплавкие металлыСреднеплавкие металлы переходят из твердого состояния в жидкое при температурах от 600 ° С до 1600 ° С. Из них делают пластины, арматуру. , блоки и другие металлоконструкции, пригодные для строительства. В эту группу металлов входят железо, медь, алюминий, они также входят во многие сплавы. Медь добавляют в сплавы драгоценных металлов, таких как золото, серебро и платина. Золото 750 на 25% состоит из лигатурных металлов, в том числе меди, которая придает ему красноватый оттенок.Температура плавления этого материала составляет 1084 ° C. А алюминий начинает плавиться при относительно низкой температуре 660 градусов по Цельсию. Это легкий, пластичный и недорогой металл, который не окисляется и не ржавеет, поэтому его широко используют при производстве посуды. Температура 1539 градусов. Это один из самых популярных и доступных металлов, широко применяемый в строительстве и автомобилестроении. Но поскольку утюг подвергается коррозии, его следует дополнительно обработать и покрыть защитным слоем краски, олифы или не допустить его намокания. Тугоплавкие металлыТемпература тугоплавких металлов превышает 1600 ° С. Это вольфрам, титан, платина, хром и другие. Они используются в качестве источников света, деталей машин, смазочных материалов и в атомной промышленности. Они используются для изготовления проводов, высоковольтных кабелей и для плавления других металлов с более низкой температурой плавления. Платина начинает переходить из твердого состояния в жидкое при 1769 градусах, а вольфрам - при 3420 ° C. Ртуть - единственный металл, который является жидким при нормальных условиях, а именно при нормальном атмосферном давлении и средней температуре окружающей среды.Температура плавления ртути составляет минус 39 ° C. Этот металл и его пары токсичны и поэтому используются только в закрытых контейнерах или в лабораториях. Обычное применение ртути - термометр для измерения температуры тела. .Температура плавления различных веществ - таблица. Температура кипения и плавленияКаждый металл и сплав обладает своим уникальным набором физических и химических свойств, среди которых точка плавления не является последней. Сам процесс представляет собой переход тела из одного физического состояния в другое, в данном случае из твердого кристаллического состояния в жидкое. Чтобы расплавить металл, необходимо нагреть его до температуры плавления. Благодаря ему он еще может оставаться твердым, но при дальнейшей выдержке и повышении температуры металл начинает плавиться.Если понизить температуру, т.е. отвести немного тепла, элемент затвердеет. Самая высокая температура плавления среди металлов принадлежит вольфраму : она составляет около 3422 ° C, самая низкая - для ртути: элемент уже плавится при -39 ° C прибл. Как правило, для сплавов невозможно определить точное значение: оно может значительно варьироваться в зависимости от процентного соотношения компонентов. Обычно они записываются в виде числового интервала. Как продвигается При повышении температуры и амплитуде тепловых колебаний молекул появляются структурные дефекты сетки, которые выражаются в увеличении дислокации, скачке атомов и других нарушениях. Это сопровождается разрывом межатомных связей и требует определенного количества энергии.При этом на поверхности тела образуется квазижидкий слой. Период разрушения сети и накопления дефектов называется плавлением. По температуре плавления металлы делятся на: В зависимости от температуры плавления выбирался также плавильный аппарат ... Чем выше показатель, тем он должен быть прочнее. Проверить температуру необходимого элемента можно в таблице. Еще одно важное значение - температура кипения. Это значение, при котором жидкость начинает закипать, оно соответствует температуре насыщенного пара, который образуется над плоской поверхностью кипящей жидкости.Обычно это почти вдвое выше точки плавления. Обычно оба значения дают при нормальном давлении. Между собой прямо пропорционально .
Таблица легкоплавких металлов и сплавов (до 600C o)Таблица металлов и сплавов средней плавкости (от примерно 600 ° C до примерно 1600 ° C)Почти все металлы твердые при нормальных условиях.Но при определенных температурах они могут изменить свое физическое состояние и стать жидкими. Давайте выясним, какова самая высокая температура плавления металла? Какая самая низкая? Температура плавления металловБольшинство элементов периодической системы элементов относятся к металлам. В настоящее время их около 96. Все они нуждаются в разных условиях, чтобы превратиться в жидкость. Порог нагрева кристаллических твердых тел, после которого они становятся жидкими, называется точкой плавления.В случае с металлами он колеблется от нескольких тысяч градусов. Многие из них переходят в жидкость при относительно сильном нагреве. Это делает их обычным материалом для производства кастрюль, сковородок и другой кухонной утвари. Средние температуры плавления: серебро (962 ° C), алюминий (660,32 ° C), золото (1064,18 ° C), никель (1455 ° C), платина (1772 ° C) и т. Д. тугоплавкие и легкоплавкие металлы. Первому нужно больше 2000 градусов по Цельсию, чтобы превратиться в жидкость, второму - меньше 500 градусов. К легкоплавким металлам обычно относятся олово (232 ° C), цинк (419 ° C), свинец (327 ° C). Однако некоторые из них могут иметь даже более низкие температуры. Например, фран и галлий уже плавятся в руке, а цезий можно нагреть только в ампуле, так как он воспламеняется от кислорода. Самая низкая и самая высокая точки плавления металлов показаны в таблице: ВольфрамМеталлический вольфрам имеет самую высокую температуру плавления. Над ним на этом индикаторе только неметаллический углерод.Вольфрам - это светло-серое блестящее вещество, очень плотное и тяжелое. Температура кипения составляет 5 555 ° C, что почти равно температуре фотосферы Солнца. Слабо реагирует с кислородом при внутренних условиях и не коррозирует. Несмотря на свою неплавкость, он довольно пластичен и склонен к фальсификации даже при нагревании до 1600 ° C. Эти свойства вольфрама используются для изготовления нитей в лампах и кинескопов для сварочных электродов. Большая часть добытого металла сплавлена со сталью для увеличения ее прочности и твердости. Вольфрам широко используется в военной сфере и технике. Он необходим для производства боеприпасов, брони, двигателей и важнейших частей военной техники и самолетов. Также из него изготавливают хирургические инструменты, ящики для хранения радиоактивных веществ. РтутьРтуть - единственный металл с отрицательной температурой плавления. Более того, это один из двух химических элементов, простые вещества из которых обычно существуют в виде жидкостей.Интересно, что металл закипает при нагревании до 356,73 ° C, что намного выше его точки плавления. Имеет серебристо-белый цвет и ярко выраженный блеск. Он испаряется даже в комнатных условиях, конденсируясь в маленькие шарики. Металл очень токсичен. Он может накапливаться во внутренних органах человека, вызывая заболевания мозга, селезенки, почек и печени. Ртуть - один из первых семи металлов, открытых человеком. В средние века он считался основным алхимическим элементом.Несмотря на свою токсичность, когда-то он использовался в медицине как часть зубных пломб и как средство от сифилиса. В настоящее время ртуть практически полностью исключена из медицинских препаратов, но широко используется в измерительных приборах (барометрах, манометрах), при производстве ламп, выключателей, дверных звонков. СплавыЧтобы изменить свойства определенного металла, его комбинируют с другими веществами. В результате он может не только получить более высокую плотность и прочность, но также снизить или повысить температуру плавления. Сплав может состоять из двух или более химических элементов, но по крайней мере один из них должен быть металлом. Такие «смеси» очень часто используются в промышленности, потому что с их помощью можно получить именно те свойства материалов, которые необходимы. Температура плавления металлов и сплавов зависит от чистоты первых, а также от пропорции и состава вторых. Наиболее распространенными типами легкоплавких сплавов являются свинец, ртуть, таллий, олово, кадмий и индий.Те, что содержат ртуть, называются амальгамами. Соединение натрия, калия и цезия в соотношении 12% / 47% / 41% становится жидкостью уже при минус 78 ° C, ртутно-таллиевой амальгамой при минус 61 ° C. Самый тугоплавкий материал - это сплав 1: 1 карбидов тантала и гафния с температурой плавления 4115 ° C. Точка плавления, наряду с плотностью, относится к физическим свойствам металлов . Температура плавления металла - Температура, при которой металл изменяется от твердого до нормального (кроме ртути) при нагревании до жидкого состояния.При плавлении объем металла практически не меняется, поэтому температура плавления нормальная Атмосферное давление не влияет на . Температура плавления металлов колеблется от -39 градусов Цельсия до +3410 градусов ... Большинство металлов имеют высокую температуру плавления, однако некоторые металлы можно расплавить в домашних условиях путем нагревания с помощью обычной горелки (олово, свинец). Классификация по температуре плавления металлов
Таблица температур плавления металлов и сплавов
При плавке металла для производства металлических изделий, отливок, подбор оборудования, материала для обработки пластмасс и т. Д.зависит от температуры плавления. Также следует помнить, что при сплавлении металла с другими элементами температура плавления чаще всего падает до .
Каждый металл или сплав обладает уникальными свойствами, включая температуру плавления.В этом случае объект переходит из одного состояния в другое, в конкретном случае из твердого состояния в жидкое. Чтобы расплавить его, его необходимо нагреть и повторно нагреть до тех пор, пока не будет достигнута желаемая температура ... Когда желаемая точка будет достигнута, температура этого сплава все еще может оставаться твердой. При постоянном воздействии начинает таять. Контакт Самая низкая температура плавления у ртути - она плавится даже при -39 ° C, самая высокая для вольфрама - 3422 ° C.Для сплавов (стали и др.) Указать точное количество крайне сложно. Все зависит от пропорций ингредиентов, которые они содержат. В случае сплавов он сохраняется как числовой интервал. Как работает процесс При происходит нагрев , амплитуда тепловых колебаний молекул увеличивается. Возникает структурных дефектов сетки, сопровождаются разрывом межатомных связей. Период разрушения сети и накопления дефектов называется плавлением. В зависимости от степени плавления металлов делятся на:
В зависимости от максимальной степени выбирается также расплавитель. Чем сильнее нагрев, тем он должен быть сильнее. Вторая важная величина - это степень кипения. Это параметр, при котором жидкость закипает. Как правило, это вдвое больше скорости плавления. Эти значения прямо пропорциональны друг другу и обычно указываются при нормальном давлении. Скорость плавления увеличивается с увеличением давления.Если давление падает, оно падает. Таблица характеристик Чтобы найти этот параметр, необходимо обратиться к таблице.Температуру кипения также можно найти в таблице. Среди наиболее часто используемых элементов в повседневной жизни индексы температуры плавления следующие:
Как видно из этой части таблицы, наиболее легкоплавким металлом является ртуть, которая уже при положительных температурах находится в жидком состоянии. Степень кипения всех этих элементов почти в два раза, а иногда даже превышает степень плавления. Например, для золота это 2660 ° C, для алюминия - 2519 ° C , для железа - 2900 ° C, для меди - 2580 ° C, для ртути - 356,73 ° C. Для сплавов, таких как сталь, чугун и другие металлы, расчет примерно такой же и зависит от соотношения компонентов в сплаве. Максимальная температура кипения металлов составляет рений - 5596 ° C ... Большинство тугоплавких материалов имеют самую высокую точку кипения. Есть таблицы, в которых также указывается плотность металлов ... Самый легкий металл - литий, самый тяжелый - осмий. Осмий имеет более высокую плотность, чем уран и плутоний, если рассматривать его при комнатной температуре... К легким металлам относятся: магний, алюминий, титан. Самые популярные металлы - тяжелые: железо, медь, цинк, олово и многие другие. Последняя группа - это очень тяжелые металлы, такие как вольфрам, золото, свинец и другие. Другой индекс, найденный в таблицах, - это теплопроводность металлов ... Нептуний - худший проводник тепла, а серебро - металл с лучшей теплопроводностью. Золото, сталь, железо, чугун и другие элементы находятся в середине этих двух крайностей.Четкие характеристики каждого из них можно найти в выбранной таблице. Самое удивительное и полезное свойство воды для живой природы - это ее способность быть текучей в «нормальных» условиях. Молекулы, очень похожие на водные соединения (например, молекулы h3S или h3Se), намного тяжелее и в тех же условиях образуют газ. Таким образом, вода как бы противоречит закономерностям таблицы Менделеева, которая, как известно, предсказывает, когда, где и по каким свойствам вещества будут близки.В нашем случае таблица показывает, что свойства водородных соединений элементов (называемых гидридами), расположенных в одних и тех же вертикальных столбцах, должны монотонно изменяться с увеличением массы атомов. Кислород - это элемент шестой группы этой таблицы. В эту же группу входят сера S (атомная масса 32), селен Se (атомная масса 79), теллур Te (атомная масса 128) и полоний Po (атомная масса 209). Следовательно, свойства гидридов этих элементов должны монотонно изменяться при переходе от тяжелых элементов к более легким, т.е.в последовательности h3Po> h3Te> h3Se> h3S> h3O. Именно это и происходит, но только с первыми четырьмя гидридами. Например, температура кипения и плавления увеличивается с увеличением атомной массы элементов. На рисунке крестиками обозначены точки кипения этих гидридов, а кружками - точки плавления. Как видите, с уменьшением атомной массы температура падает полностью линейно. Область существования жидкой фазы гидридов становится все более «холодной», и если бы гидрид кислорода h3O был нормальным соединением, как его соседи в шестой группе, то жидкая вода существовала бы в диапазоне -80. ° С до -95 ° С.При высоких температурах h3O всегда будет газом. К счастью для нас и для всего живого на Земле, вода ненормальная, она не распознает периодические закономерности, но следует своим законам. Объясняется просто - большинство молекул воды связаны водородными связями. Именно эти связи отличают воду от жидких гидридов h3S, h3Se и h3Te. Если бы их не было, вода уже закипела бы при минус 95 ° C. Энергия водородных связей достаточно высока, и их можно разорвать только при гораздо более высокой температуре.Даже в газообразном состоянии большое количество молекул h3O сохраняет свои водородные связи, объединяясь с образованием димеров (h3O) 2. Полностью водородные связи исчезают только при температуре водяного пара 600 ° C. Напомним, что кипение - это образование пузырьков пара в кипящей жидкости. При нормальном давлении чистая вода закипает при температуре 100 ° C. В случае притока тепла через свободную поверхность процесс поверхностного испарения будет ускоряться, но объемного испарения, характерного для кипения, не происходит.Приготовление пищи также можно производить за счет уменьшения внешнего давления, так как в этом случае давление пара равно внешнему давлению, оно достигается при более низкой температуре. высокое верхнее давление и, соответственно, температура кипения настолько низки, что вода становится непригодной для приготовления пищи - не достигается требуемая температура воды. При достаточно высоком давлении вода может быть нагрета достаточно, чтобы расплавить свинец (327 ° C), но при этом не выкипеть. За пределами сверхвысоких точек кипения (а последний процесс требует слишком высокой теплоты плавления для такой простой жидкости), сам диапазон существования воды является аномальным - сотни градусов, на которые изменяются эти температуры, - довольно большой диапазон. для жидкости с низким молекулярным весом, такой как вода.Пределами являются чрезвычайно высокие допустимые значения переохлаждения и перегрева воды - при слабом нагревании или охлаждении вода остается жидкой от -40 ° C до +200 ° C. Таким образом, температурный диапазон, в котором вода может оставаться жидкой, простирается до 240 ° C. Когда лед нагревается, сначала повышается его температура, но с момента образования смеси льда и воды температура будет оставаться неизменной до тех пор, пока весь лед не растает. Это связано с тем, что тепло, подводимое к таянию льда, в первую очередь расходуется только на разрушение кристаллов.Температура тающего льда остается неизменной до тех пор, пока все кристаллы не будут разрушены (см. Скрытую теплоту плавления). .Рейн | KGHM Корпоративный сайтОбщая информация Рений - драгоценный и очень редкий металл. Его температура плавления составляет 3186 ° C, что является третьей по величине точкой плавления среди всех элементов. Благодаря самой высокой температуре кипения (5596 ° C), высокой плотности (21,03 г / см³), а также высокой твердости и устойчивости к коррозии и деформации, рений является уникальным металлом. Рейн - это я. стратегический металл для применений, требующих устойчивости к экстремально высоким температурам. Благодаря своим уникальным свойствам рений используется, в частности, в для производства деталей турбин реактивных двигателей, газовых турбин и кожухов космических аппаратов. Использование рения позволяет двигателям работать при более высоких температурах, что улучшает их характеристики и позволяет снизить расход топлива. Этот металл также используется в нефтехимической промышленности, где он используется в качестве катализатора при производстве высокооктановых бензинов. Он также используется для производства нагревательных элементов, электрических контактов, электродов, электромагнитов, вакуумных и рентгеновских трубок, импульсных ламп, металлических покрытий и компонентов ракетных двигателей. Уникальные свойства рения делают его интересным металлом для всех областей применения, требующих устойчивости к высоким температурам, повреждениям и деформации. В KGHM рений является побочным продуктом процесса производства меди. Рений металлический Металлический рений производства KGHM находится в форме серых таблеток. Он используется в производстве суперсплавов, которые затем используются, в частности, в для производства компонентов двигателей для авиационной промышленности и газовых турбин.Он также используется в производстве нитей и термозащитных покрытий. Высокое качество металлического рения KGHM гарантировано сертификатами признанных мировых лабораторий, а стабильность качества и поставок постоянным источником этого металла KGHM - собственными месторождениями меди, содержащими этот ценный элемент.
Технические характеристики гарантированы - рений металлический (PDF 146 KB) Паспорт безопасности - металлический рений (PDF 149 KB) Если вы заинтересованы в приобретении этого продукта, позвоните в отдел продаж по телефону +48 767478898 или воспользуйтесь контактной формой . перренат аммония Перренат аммония имеет вид белого кристаллического порошка. Он используется в нефтехимической промышленности для производства катализаторов для получения высокооктановых бензинов.Он также является промежуточным продуктом для производства рения и порошка металлического рения. Высокое качество перрената аммония KGHM гарантировано сертификатами признанных мировых лабораторий, а стабильность качества и поставок постоянным источником этого металла KGHM - собственными месторождениями меди, содержащими этот ценный элемент.
Паспорт безопасности - перренат аммония (PDF 148 KB) Если вы заинтересованы в приобретении этого продукта, позвоните в отдел продаж по телефону +48 767478898 или воспользуйтесь контактной формой . Рениевый порошок Порошок рения используется, в частности, в в медицинской промышленности. Он используется в качестве добавки к суперсплавам, используемым при производстве компонентов, требующих стойкости к высоким температурам, в том числев компоненты двигателей для авиационной промышленности, газовые турбины, нити и тепловые экраны. Также ведется интенсивная работа по использованию рения в составе смесей, используемых в 3D-принтерах. Рениевый порошок с минимальным содержанием рения 99,7% (включая газообразные загрязнители) производится по индивидуальным заказам клиентов. Если вы заинтересованы в приобретении этого продукта, позвоните в отдел продаж по телефону +48 767478898 или воспользуйтесь контактной формой . .Общая информация о металлах, наиболее часто используемых для изготовления украшений • PLATINUM Химический знак Pt; плотность 21,45 г / см 3; точка плавления 1773,5 o C, точка кипения 4127 o C. • ТИТАН (Ti) Химическое обозначение Ti; плотность 4,5 г / см 3; температура плавления 1669 o C, температура кипения 3500 o C. • ЗОЛОТО Химический знак Au; плотность 19,3 г / см 3; точка плавления 1062,4 o C, точка кипения 2600 o C. • СЕРЕБРЯНЫЙ Химическое обозначение Ag; плотность 10,5 г / см 3; Т.пл. 960,5 ° С; температура кипения 2200 o C. • МЕДЬ Химическое обозначение Cu; плотность 8,96 г / см 3; Т.пл. 1083 ° С; температура кипения 2310 o C. • ЛАТУНЬ Латунь - это медно-цинковый сплав. Они плавкие и, как и бронзы, подходят для литья, но менее долговечны. В зависимости от процентного содержания отдельных компонентов латунь может быть желтой или красноватой. Иногда в эти сплавы добавками являются олово и свинец. Литейная латунь содержит 55-70% меди, 30-45% цинка и до 3% свинца. • КОРИЧНЕВЫЙ Бронзы - это сплавы меди с оловом (чаще всего 10% олова, 90% меди). Они особенно полезны для литья, поскольку из-за их твердости и долговечности небольшая примесь цинка еще больше увеличивает полезность бронзы. При содержании олова более 30% коричневый цвет меняется на белый. В воздухе бронза покрывается зеленой патиной. • НЕРЖАВЕЮЩАЯ СТАЛЬ Нержавеющая сталь (иначе благородная - сплав железа, углерода и хрома с добавками) ведет себя аналогично благородным металлам, превосходя их по твердости и полируемости.Он не ржавеет, потому что на его поверхности образуется тонкий слой оксидов хрома, который защищает его от коррозии. Он не намагничивается и не затвердевает при охлаждении. Только ковка или прокатка немного твердеют. Мягкость может быть увеличена накаливанием и охлаждением в воде или спирте. Работа с нержавеющей сталью требует использования кислородно-водородной горелки. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||




 Элементы, какими бы они ни были: золото, железо, чугун, сталь или что-нибудь еще, плавятся более или менее одинаково.Это случай с внешним или внутренним отоплением. Внешний нагрев происходит в термической печи. Для резистивного обогрева для внутреннего использования, электрически или индуктивно проницаемого Нагрев в высокочастотном электромагнитном поле ... Эффект примерно такой же.
Элементы, какими бы они ни были: золото, железо, чугун, сталь или что-нибудь еще, плавятся более или менее одинаково.Это случай с внешним или внутренним отоплением. Внешний нагрев происходит в термической печи. Для резистивного обогрева для внутреннего использования, электрически или индуктивно проницаемого Нагрев в высокочастотном электромагнитном поле ... Эффект примерно такой же. 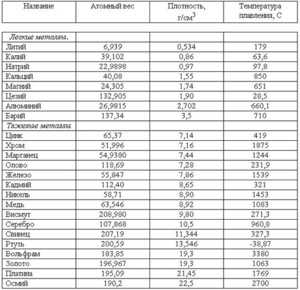 Металлы и сплавы - необходимые поковка, основа , литейное производство, ювелирные изделия и многие другие отрасли производства.Что бы ни делал мастер ( золотых украшений , чугунные заборы, стальные ножи или браслеты из меди) необходимо знать температуры, при которых плавится тот или иной элемент для правильной работы.
Металлы и сплавы - необходимые поковка, основа , литейное производство, ювелирные изделия и многие другие отрасли производства.Что бы ни делал мастер ( золотых украшений , чугунные заборы, стальные ножи или браслеты из меди) необходимо знать температуры, при которых плавится тот или иной элемент для правильной работы. 

 Помимо способности переходить из твердого состояния в жидкое, одним из важных свойств материала является его прочность - устойчивость твердого тела к разрушению и необратимым изменениям формы. Основным показателем прочности является сопротивление в результате разрушения предварительно отожженной заготовки.Прочность не распространяется на ртуть, поскольку она находится в жидком состоянии. Определение прочности принимается в МПа - мегапаскалях.
Помимо способности переходить из твердого состояния в жидкое, одним из важных свойств материала является его прочность - устойчивость твердого тела к разрушению и необратимым изменениям формы. Основным показателем прочности является сопротивление в результате разрушения предварительно отожженной заготовки.Прочность не распространяется на ртуть, поскольку она находится в жидком состоянии. Определение прочности принимается в МПа - мегапаскалях.  Как видно из таблицы, температуры плавления компонентов значительно различаются даже для материалов, которые используются в повседневной жизни.
Как видно из таблицы, температуры плавления компонентов значительно различаются даже для материалов, которые используются в повседневной жизни. 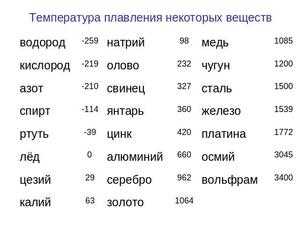 Все металлы плавятся примерно одинаково - с внешним или внутренним нагревом.Первый происходит в термической печи, второй включает резистивный нагрев путем пропускания электрического тока или индукционный нагрев в высокочастотном электромагнитном поле. Оба варианта воздействуют на металл примерно одинаково.
Все металлы плавятся примерно одинаково - с внешним или внутренним нагревом.Первый происходит в термической печи, второй включает резистивный нагрев путем пропускания электрического тока или индукционный нагрев в высокочастотном электромагнитном поле. Оба варианта воздействуют на металл примерно одинаково. 


 Элементы, какими бы они ни были: золото, железо, чугун, сталь или что-то еще, плавятся более или менее одинаково. Это бывает при внешнем или внутреннем обогреве. Внешний нагрев происходит в термической печи. Для внутреннего использования резистивный обогрев, байпас Электричество или индукция высокочастотный электромагнитный обогрев ... Воздействие примерно такое же.
Элементы, какими бы они ни были: золото, железо, чугун, сталь или что-то еще, плавятся более или менее одинаково. Это бывает при внешнем или внутреннем обогреве. Внешний нагрев происходит в термической печи. Для внутреннего использования резистивный обогрев, байпас Электричество или индукция высокочастотный электромагнитный обогрев ... Воздействие примерно такое же. 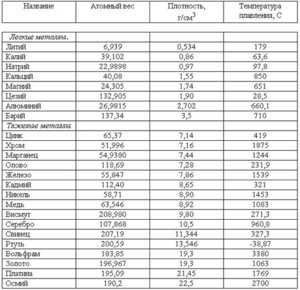 Металлы и сплавы - необходимая база для ковки , литья, ювелирных изделий и многих других областей производства. Вне зависимости от мастера ( Украшения из золота , чугунные заборы, стальные ножи или браслеты из меди) , для корректной работы необходимо знать температуры, при которых плавится тот или иной элемент.
Металлы и сплавы - необходимая база для ковки , литья, ювелирных изделий и многих других областей производства. Вне зависимости от мастера ( Украшения из золота , чугунные заборы, стальные ножи или браслеты из меди) , для корректной работы необходимо знать температуры, при которых плавится тот или иной элемент.