|
|
Хим свойства водыОсновные физико-химические характеристики водыХимически чистая вода h3O бесцветна, не имеет запаха и вкуса, в относительно толстом слое кажется окрашенной в голубоватый цвет. Молекула воды состоит из двух одновалентных ионов водорода H+ и двухвалентного ионы кислорода О2—, которые расположены в вершинах равнобедренного треугольника. Угол у вершины треугольника, занятый ионом кислорода, равен 104,5°, длина связи О—Н равна 0,096 нм, расстояние между ионами Н+ равно 0,15 нм, размер молекулы воды считается близким к 0,28 нм (рис. 1.1). Рис. 1.1. Простейшая схема молекулы воды
Ближе к реальности представление молекулы h3O в форме пространственной фигуры — тетраэдра с двумя положительными вершинами на ионах водорода Н+ и двумя отрицательными вершинами на вытянутых электронных орбитах иона кислорода (рис. 1.2). Иногда упрощенно молекулы воды изображают в виде диполя (рис. 1.3), поскольку центры положительных и отрицательных зарядов не совпадают. Рис. 1.2. Представление молекулы воды в виде тетраэдра Рис. 1.3. Представление молекулы воды в виде диполя Особенностью молекул воды являются способность соединяться между собой в многозвенные ассоциаты за счет образования водородных связей (рис. 1.4). Рис. 1.4. Схема образования водородных связей между молекулами воды
Поскольку у молекулы имеются как бы четыре полюса электрических зарядов, то каждая молекула связывается с четырьмя другими молекулами, располагающимися также в вершинах тетраэдра (рис. 1.5). Рис. 1.5. Пространственный ассоциат в виде тетраэдра из молекул воды Эти пятизвенные тетраэдры частично соединяются между собой, образуя более сложные пространственные структуры. Ассоциаты не являются устойчивыми постоянными пространственными элементами структуры воды. Вследствие теплового движения ориентация молекул изменяется, что приводит к распаду существующих ассоциатов и образованию новых. Продолжительность жизни ассоциатов предполагается близкой к 10—12—10—11 секунд. Столь быстрое установление и разрушение пространственных упорядоченных элементов делает структуру воды исключительно изменчивой («мерцающей»), а упорядочение носит статистический характер. Степень ассоциированности зависит от температуры воды. Полностью все молекулы ассоциированы между собой в единую жесткую пространственную структуру только во льду, причем при температуре ниже —183° С. При более высокой температуре часть водородных связей разрушается; считается, что вблизи температуры плавления (0° С) разрушаются 9–16% общего количества водородных связей, а при 40° С — примерно половина. При переходе в газообразное состояние (в пар) разрушаются практически все водородные связи, очень небольшая часть молекул воды соединена в двойные агрегаты (дигидроли). Изменение степени ассоциированности оказывает столь заметное влияние на свойства воды, что, по мнению некоторых специалистов, воду при 25—75°С и воду вблизи 0°С можно рассматривать как два различных по своей природе растворителя. Жидкую воду можно представить состоящей из областей двух видов — «льдоподобных» с ассоциированными молекулами и «плотноупакованных» со свободными отдельными молекулами. Такие области, включающие 102–103 молекул, постоянно разрушаются и вновь возникают. Энергия водородных связей составляет около 18,9 кДж/моль (4,5 ккал/моль), она значительно меньше энергии химической связи, составляющей более 100 кДж/моль. В то же время эта энергия превышает энергию вандервальсовых сил (9,6 кДж/моль) и энергию теплового движения молекул (около 2,5 кДж/моль при 27° С). Энергия образования молекул воды из водорода и кислорода представляет собой достаточно большую величину — 242 кДж/моль, что обусловливает высокую устойчивость молекул. Вода не изменяется под действием большинства соединений, которые растворяет, и считается инертным растворителем. Вода имеет большую диэлектрическую проницаемость, кроме того ее молекулы представляют собой диполи, поэтому обладает высокой растворяющей способностью по отношению к полярным соединениям из-за снижения межатомных и межмолекулярных сил. Ионы растворенных веществ размещаются в структуре воды или в ее полостях, либо замещая молекулы Н2О. В любом случае они вызывают изменение структуры воды: во-первых, из-за несовпадения размеров иона и молекулы h3O, во-вторых, из-за изменения ориентации молекул Н2О вследствие влияния иона. Крупные слабозаряженные ионы разрушают структуру воды. Небольшие высокозаряженные ионы способствуют структурообразованию в воде, правда, эти структуры могут отличаться от характерной для воды льдоподобной структуры. Однако все эти эффекты справедливы до температуры 40—50°С, при более высокой температуре все ионы способствуют упрочнению структуры воды. Эффект разрушения — упрочнения структуры сказывается на таких параметрах, как вязкость, диффузия и, соответственно, зависящих от них явлений очистки воды (коагуляция, осаждение и т.д.) Образование структур из дипольных молекул воды вокруг ионов растворимых веществ или других заряженных частиц носит название гидратации. Чем выше заряд иона и чем меньше его размеры, тем сильнее он гидратируется, тем большее количество молекул воды входит в гидратную оболочку иона. Катионы, как правило, гидратируются сильнее, чем анионы.
Образование водородных связей и структурирование обусловливают многие исключительные свойства воды, отличающие ее от водородных соединений соседних элементов (аномалии воды). Ниже приводятся основные параметры воды. Самостоятельная работа по теме " Химические свойства воды"2. Какие из веществ вступают в реакцию реакций: Mn2O7 + h3O→ BaO+ h3O→ K+ h3O→ P2O5+ h3O→ h3+ h3O→ SiO2+ h3O→ с водой: золото, оксид азота (III), кислород, оксид хрома (II), цинк, оксид натрия, алюминий. Напишите уравнения осуществимых реакций. помощью которых можно осуществить превращения: +h3O KMnO4 → O2 → SO3 → ? 3. Напишите уравнения реакций, с 1. Допишите уравнения осуществимых 2. Какие из веществ вступают в реакцию реакций: K2O + h3O→ Ba+ h3O→ Fe+ h3O→ N2O5+ h3O→ I2+ h3O→ NiO+ h3O→ с водой: оксид железа (II),сера, барий, медь, оксид серы (IV), железо, оксид кальция. Напишите уравнения осуществимых реакций. помощью которых можно осуществить превращения: +h3O 3. Напишите уравнения реакций, с h3O2 → O2 → Li2O → ? Вариант 5 Химические свойства воды-2 Вариант 1 Химические свойства воды-2 Вариант 2 Химические свойства воды-2 1. Допишите уравнения осуществимых 2. Какие из веществ вступают в реакцию реакций: Al2O3 + h3O→ BaO+ h3O→ Li+ h3O→ CO2+ h3O→ C+ h3O→ Ni+ h3O→ с водой: золото, оксид азота (V), кислород, оксид хрома (II), цинк, оксид натрия, алюминий. Напишите уравнения осуществимых реакций. помощью которых можно осуществить превращения: +h3O KClO3 → O2 → P2O3 → ? 3. Напишите уравнения реакций, с Вариант 3 Химические свойства воды-2 1. Допишите уравнения осуществимых реакций: Cr2O3 + h3O→ CaO+ h3O→ Al+ h3O→ CrO3+ h3O→ Si + h3O→ Zn+ h3O→ 2. Какие из веществ вступают в реакцию с водой: фосфор, кальций, оксид железа (III), медь, оксид углерода (IV), оксид калия, железо. Напишите уравнения осуществимых реакций. 3. Напишите уравнения реакций, с помощью которых можно осуществить превращения: +h3O h3O→ O2 → K2O → ? Вариант 4 Химические свойства воды-2 1. Допишите уравнения осуществимых Вариант 6 Химические свойства воды-2 1. Допишите уравнения осуществимых 2. Какие из веществ вступают в реакцию реакций: Al2O3 + h3O→ BaO+ h3O→ Li+ h3O→ CO2+ h3O→ C+ h3O→ Ni+ h3O→ с водой: золото, оксид азота (V), кислород, оксид хрома (II), цинк, оксид натрия, алюминий. Напишите уравнения осуществимых реакций. помощью которых можно осуществить превращения: +h3O KClO3 → O2 → P2O3 → ? 3. Напишите уравнения реакций, с Вариант 8 Химические свойства воды 1. Допишите уравнения осуществимых реакций: Cr2O3 + h3O→ CaO+ h3O→ Al+ h3O→ CrO3+ h3O→ Si + h3O→ Zn+ h3O→ 2. Какие из веществ вступают в реакцию с водой: фосфор, кальций, оксид железа (III), медь, оксид углерода (IV), оксид калия, железо. Напишите уравнения осуществимых реакций. 3. Напишите уравнения реакций, с помощью которых можно осуществить превращения: +h3O h3O→ O2 → K2O → ? Вариант 7 Химические свойства воды 1. Допишите уравнения осуществимых реакций: Mn2O7 + h3O→ BaO+ h3O→ K+ h3O→ P2O5+ h3O→ 1. Допишите уравнения осуществимых реакций: K2O + h3O→ Ba+ h3O→ Fe+ h3O→ N2O5+ h3O→ 2. Какие из веществ вступают в реакцию h3+ h3O→ SiO2+ h3O→ с водой: золото, оксид азота (III), кислород, оксид хрома (II), цинк, оксид натрия, алюминий. Напишите уравнения осуществимых реакций. помощью которых можно осуществить превращения: +h3O KMnO4 → O2 → SO3 → ? 3. Напишите уравнения реакций, с 2. Какие из веществ вступают в реакцию I2+ h3O→ NiO+ h3O→ с водой: оксид железа (II),сера, барий, медь, оксид серы (IV), железо, оксид кальция. Напишите уравнения осуществимых реакций. помощью которых можно осуществить превращения: +h3O 3. Напишите уравнения реакций, с h3O2 → O2 → Li2O → ? Вода как реагент и как среда для химического процесса (аномальные свойства воды)
Химический факультет
Реферат по дисциплине : Химия «Вода как реагент и как среда для химического процесса (аномальные свойства воды)»
Выполнила студентка I курса Химического факультета Учебной группы ЭПБ – 11 Мисюкевич Дарья Анатольевна
Преподаватель: к.п.н Даровских Л.В.
Киров 2013
План:
1.Введение Вода́ (оксид водорода) — бинар Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, льды) — 361,13 млн км. На Земле примерно 96,5 % воды приходится на океаны, 1,7 % мировых запасов составляют грунтовые воды, ещё 1,7 % на ледники и ледяные шапки Антарктиды и Гренландии, небольшая часть в реках, озёрах и болотах, и 0,001 % в облаках (образуются из взвешенных в воздухе частиц льда и жидкой воды). Бо́льшая часть земной воды — солёная, и она непригодна для сельского хозяйства и питья. Доля пресной составляет около 2,5 %, причём 98,8 % этой воды находится в ледниках и грунтовых водах. Менее 0,3 % всей пресной воды содержится в реках, озёрах и атмосфере, и ещё меньшее количество (0,003 %) находится в живых организмах. Является хорошим сильнополярным раствор Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Является важнейшим веществом для всех живых существ на планете Земля.
На Земле происходит непрерывный круговорот воды, включающий использование воды на бытовые и производственные нужды человека, использование воды растениями и животными, испарение воды и фильтрацию ее через почву многое другое. Характер процессов, протекающих с участием воды, во многом определяется ее свойствами как индивидуального вещества. Вода – самое удивительное соединение на Земле.
2.Внутренняя структура молекул воды Вода (оксид водорода) h3O − простейшее устойчивое соединение водорода с кислородом. Молекулярная масса воды 18,0160, на водород приходится 11,19 % по массе, а на кислород – 88,81 %. Восемь электронов внешнего электронного слоя атома кислорода образуют четыре электронные пары, из которых 2 создают ковалентные связи О−Н, а две другие представляют собой неподеленные электронные пары. С современных позиций строения атома электронное облако молекулы воды имеет вид усеченного четырехлопастного винта, который может быть размещен в неправильном кубе (неправильный тетраэдр). Атом кислорода оказывается при этом в центре, а два атома водорода − в противоположных углах одной из граней куба. Угол между ними составляет 104°31'. Два из восьми электронов атома кислорода расположены около ядра, два других связаны с атомами водорода, а две неподеленные пары электронов образуют ветви, расположенные в противоположном направлении по отношению к электронным облакам водородов. Таким образом, электронное облако молекулы воды имеет вид четырех лепестков, направленных к вершинам неправильного тетраэдра. В двух вершинах одной грани находятся электронные пары, осуществляющие связь О—Н, а в двух вершинах противоположной грани находятся неподеленные электронные пары атома кислорода .Электронное облако в молекуле воды смещается к атому кислорода, так как он имеет большую электроотрицательность. Вследствие этого вблизи ядер атомов водорода создается избыток положительного заряда. Поэтому молекула воды полярна. Полярные молекулы характеризуются электрическим моментом диполя, который влияет на свойства веществ, состоящих из таких молекул. Электрический момент диполя представляет собой произведение одного из зарядов на расстояние между центрами положительного и отрицательного заряда. Расстояние между ними составляет 0,9568 Å. Для воды электрический момент диполя p = el равен 6*10-28 Кл-м или 1,8 дебая (1,8 * 10-18 ед. СГСЭ).Благодаря большому значению электрического момента диполя между молекулами воды проявляется сильное взаимодействие за счет образования водородных связей между атомом кислорода одной молекулы воды и атомом водорода другой. Водородная связь возникает в результате внедрения очень малого по мразмерам положительно поляризованного атома водорода одной молекулы в электронную оболочку отрицательно поляризованного атома кислорода другой молекулы воды. Длина водородной связи О ... Н изменяется в пределах от 1,76 А. Энергия ее составляет 17—33 кДж/моль.
Возникновение водородной связи объясняется свойством атома водорода взаимодействовать с сильно электроотрицательным элементом, например с кислородом другой молекул воды. Такая особенность водородного атома обусловливается тем, что, отдавая свой единственный электрон на образование ковалентной связи с кислородом, он остается в виде ядра очень малого размера, почти лишенного электронной, оболочки. Поэтому он не испытывает отталкивания от электронной оболочки кислорода другой молекулы воды, а, наоборот, притягивается ею, и может вступить с нею во взаимодействие. Следует отметить, что согласно принятым представлениям водородную связь нельзя рассматривать как чисто электростатическую. Согласно методу молекулярных орбиталей водородная связь образуется за счет дисперсионных сил, ковалентной связи и электростатического взаимодействия. Каждая молекула воды может образовать четыре водородных связи: две возникают при взаимодействии неподеленных электронных пар атома кислорода с атомами водорода соседних молекул воды и две дают атомы водорода, взаимодействующие с атомами Существованием водородных связей объясняется аномально высокая температура плавления воды по сравнению с водородными соединениями аналогов кислорода (h3S, h3Se, h3Te). Водородные связи и донорно-акцепторные взаимодействия способствуют возникновению высокой упорядоченности внутренней структуры в жидкой воде. Водородные связи обусловливают высокое внутреннее давление, которое и способствует появлению у воды некоторых особых свойств
3.Химические свойства воды Вода является наиболее распространённым растворителем на планете Земля, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ. Её иногда рассматривают, как амфолит — и кислоту и основание одновременно (катионH+ анион OH−). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ Вода — химически активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллоги
(при низких температурах)
Вода реагирует при нагревании:
Вода реагирует в присутствии катализатора:
Для одних и тех же атомов водорода и кислорода вода не является постоянной формой нахождения. Растения в процессе фотосинтеза разлагают воду . выделяя кислород в атмосферу. Разложение воды происходит в условиях биосферы и при процессах химического выветривания минералов. К числу наиболее распространенных среди них относятся силикаты . Их изменения в условиях биосферы можно выразить реакцией: 2Ca [Al2Si2O8] + 6 h3O = Al4 [Si4 O15] (OH) 4 + 2Ca2+ + 4OH- Выветривание других силикатов ,а также сульфидов , карбонатов, сульфатов тоже идет с разложением воды.
Существенное влияние на растворимость минералов оказывает широко распространенная в биосфере углекислота. Однако в её присутствии продолжается разложение воды:
Аномалии воды Химически чистая вода обладает рядом свойств, резко отличающих ее от других природных тел и химических аналогов (гидридов элементов 6 группы периодической системы Менделеева) и от других жидкостей. Эти особые свойства известны под названием аномалии воды. Исследуя воду и, особенно ее водные растворы, ученые раз за разом убеждались, что вода обладает ненормальными — аномальными свойствами, присущими только ей, ее Величеству — Воде, подарившей нам Жизнь и возможность мыслить. Мы даже и не подозреваем, что столь привычные и естественные свойства воды в природе, в различных технологиях, наконец, в обыденной жизни нашей являются уникальными и неповторимыми. Плотность
Поверхностное натяжение
Неорганические вещества: вода, солиВопрос 1. Какие вещества называют неорганическими? Неорганические вещества — простые вещества и соединения, не являющиеся органическими, т. е. не содержащие углерода, а также некоторые углеродосодержащие соединения (карбиды, цианиды, карбонаты, оксиды углерода и некоторые другие вещества, которые традиционно относят к неорганическим). Вопрос 2. Какие известные вам организмы содержат много воды? Алоэ, кактусы, водоросли, медуза, в плодах огурцов и др. Вопрос 3. Какие неорганические вещества мы употребляем в пищу? Почему? Воду, минеральные вещества (кальций, магний, йод, фосфор, медь и др.). Они способствуют проникновению веществ в клетки организма, протекание ферментативных и пластических процессов, участвуют в формировании и построении тканей, поддерживают осмотическое давление крови, активируют проведение возбуждения и импульсов, способствуют свертыванию крови и т. д. Вопрос 4. Какие неорганические вещества содержатся в живых организмах? Вода, соли минеральных кислот и соответствующие катионы и анионы. Вопрос 5. Что определяет уникальные физические и химические свойства воды, столь важные для существования живой материи? Уникальные физические и химические свойства воды определяются особенностями структуры её молекулы, которые возникают в результате специфического расположения электронов в атомах кислорода и водорода. Вопрос 6. Какие химические связи называют водородными? Водородные связи — это такие связи, которые возникают между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы. Вопрос 7. Какие физико — химические свойства воды наиболее важны для обеспечения жизнедеятельности клеток и многоклеточных организмов в разных условиях? Высокая теплоёмкость (способность поглощать тепло при незначительном изменении собственной температуры) воды предохраняет клетку от резких температурных колебаний, а высокая теплопроводность обеспечивает возможность равномерного распределения теплоты между отдельными частями организма. Высокая теплота испарения используется живыми организмами для предохранения от перегрева: испарение жидкости растениями и животными охлаждает организм и является защитной реакцией на повышение температуры. Вода практически несжимаема, благодаря чему клетки поддерживают свою форму и обладают упругостью. Очень важно, что лёд легче воды, так как вода имеет максимальную плотность при +4°С, поэтому пресные водоёмы не промерзают до дна. Для живых организмов весьма важно ещё и то, что молекулы воды являются диполями. Дипольный характер молекулы воды определяет её способность ориентироваться в электрическом поле. Именно это свойство воды определяет её уникальность как растворителя. Вопрос 8. В каких растворителях могут растворяться гидрофобные вещества, а в каких — гидрофильные? Какие растворители вам известны? Гидрофильные вещества легко разрушается в воде, гидрофобные — в бензине или в бензоле. Вопрос 9. Используя интернет — ресурсы и другие источники информации, найдите сведения о значении для организма следующих элементов: В, Р, S, Са, Мn, Fe, Со, Zn, Сu. Ответ оформите в виде таблицы.
Вопрос 10. Прочитайте статью «Сахар против льда» и на основе анализа полученной информации предложите свои способы борьбы с гололёдом на дорогах. При повышении безопасности дорожного движения в снежное время года, мы не должны забывать об экологической обстановке. Сахар — это интересно, экологично, но скорее всего дорого. Учитывая все недостатки при использовании соли и солевых растворов, связанных с их негативным воздействием на окружающую среду, наиболее целесообразным является способ предупреждения образования гололеда за счет создания покрытий автомобильных дорог, обладающих противо — гололедными свойствами, что делает возможным механическое удаление снежно — ледяных отложений снегоуборочной техникой и исключения отрицательного воздействия химических реагентов на окружающую среду. 1. К одному из способов образования антигололедных покрытий, разработанному в Словакии, относится «Соленый бетон». Антигололедная добавка с рабочим названием «Соленый бетон» представляет собой обработанные кристаллы против гололедного вещества (NaCl), введенные в минеральную часть асфальтобетона. Минеральная оболочка соли (NaCl) формируется из цемента, мелкозернистого известнякового порошка и дробленого песка. Введение добавки в количестве около 10 % по массе минерального материала является достаточным для достижения желаемого эффекта. При температуре около — 4°С небольшое количество соли (приблизительно 1 %) расплавляет тонкие слои снега. При температуре более низкой (ниже — 4°С) плотность льда нарушается; лед ломается и удаляется с поверхности дороги под действием колес транспортных средств. Если температура особенно низкая ( — 10°С), эффект «Соленого бетона» снижается, но сохраняется возможность достаточно простой очистки поверхности дороги с использованием дорожной щетки и отвала. 2. В Уральском государственном лесотехническом университете (УГЛТУ) для повышения противогололедных свойств асфальтобетона разработан кремнийорганический модификатор МПА — 130, не содержащий хлоридов. Устройство верхнего антигололедного слоя дорожного покрытия на основе гидрофобизирующего модификатора, не содержащего хлоридов, на автомобильных дорогах позволит вести активную борьбу с гололедом, благодаря чему повысится коэффициент сцепления колес автомобилей с дорожным покрытием и будет обеспечена нормальная работа транспорта. Кроме того, применение таких покрытий позволит улучшить экологическую обстановку придорожной полосы за счет отказа от применения хлоридов. Вопрос 11. Уникальные свойства воды определяются в том числе существованием между её молекулами водородных связей. Возможно ли существование таких связей между молекулами других веществ? Механизм возникновения водородной связи — частично электростатический и частично донорно — акцепторный. Характерной чертой водородной связи является расстояние между атомом водорода и другим атомом, её образующим. Оно должно быть меньше, чем сумма радиусов этих атомов. Межмолекулярная водородная связь образуется между молекулами веществ, в состав которых входят водород и сильно электроотрицательный элемент — фтор, кислород, азот, хлор, сера. Сильно смещенная общая электронная пара от водорода к атому отрицательно заряженного элемента, при этом положительный заряд водорода сконцентрирован в малом объеме, приводит взаимодействие протона с неподеленной электронной парой другого атома или иона, обобществляя её. Водородную связь обозначают точками, указывая, что она намного слабее ковалентной связи (примерно в 15 — 20 раз).
Межмолекулярная водородная связь: две молекулы воды и две молекулы уксусной кислоты с образованием циклической структуры Вопрос 12. Что произойдёт с клеткой, если концентрации ионов К+, Na+ и Са2+ выровняются и будут одинаковыми как вне, так и внутри её? От концентрации солей внутри и снаружи клетки зависят буферные свойства цитоплазмы клетки. Буферностью называют способность клетки сохранять определенную концентрацию водородных ионов (рН). В клетке поддерживается слабощелочная реакция (рН 7,2). Пока клетка жива, эти различия в концентрации К+ и Na+ между клеткой и межклеточной средой стойко удерживаются. Если концентрации ионов К+, Na+ и Са2+ выровняются и будут одинаковыми как вне, так и внутри её, клетка просто умрет. Вопрос 13. Используя доступные информационные источники, уточните, какие условия проведения эксперимента в естественных науках (давление, температура и др.) считаются нормальными. Обсудите с учителем и одноклассниками, почему при нормальных условиях вода (Н20) — это жидкость, а сероводород (h3S) — газ. Нормальные условия — стандартные физические условия, с которыми обычно соотносят свойства веществ (при нормальных условиях, при н. у., англ. Standard temperature and pressure, STP). Нормальные условия определены IUPAC (Международным союзом чистой и прикладной химии) следующим образом: Атмосферное давление 101325 Па = 760 мм рт. ст. Температура воздуха 273,15 K = 0° C. При нормальных условиях объём 1 моля идеального газа составляет 22,413 996(39) дм³ (молярный объём идеального газа), а количество молекул в 1 см³ составляет 2,686 7774(47)×1019 (постоянная Лошмидта). Также в справочниках в качестве стандартных условий может указываться температура 298 K, либо +25 °С (298,15 К). Однако такая температура не установлена IUPAC в качестве стандартной, поэтому при использовании справочных данных всякий раз необходимо уточнять, при каких значениях приводятся величины. Например, Национальный институт стандартов и технологий США (англ. National Institute of Standards and Technology, NIST) использует температуру +20 °C (293,15 K) и давление 101 325 Па (1 атм). Вода (Н20) — это жидкость, а сероводород (h3S) — газ. Электроотрицательность кислорода выше, чем серы, электронная плотность в молекуле воды более смещена от водорода к кислороду, чем от водорода к сере, в молекуле сероводорода. Молекулы воды образуют между собой прочные водородные связи. В сероводороде водородные связи очень слабые. Поэтому вода при комнатной температуре жидкость, а сероводород — газ. Или такой ответ, сформулированный иначе: кислород более электроотрицательный элемент, чем сера. Поэтому между молекулами воды возникают более прочные водородные связи, чем между молекулами сероводорода, разрыв этих связей, необходимый для перехода воды в газообразное состояние, требует значительной затраты энергии, что и приводит к аномальному повышению температуры кипения воды. Вода. Какими свойствами он обладает? | WP воспитаниеВода – основа жизни. На его долю приходится около 65% тела человека. Он регулирует кровяное давление, очищает организм от токсинов и поддерживает соответствующую температуру тела. Чтобы оставаться здоровым, мы должны выпивать около 2 литров воды в день. Какими свойствами он обладает? В каких агрегатных состояниях это происходит? Посмотрите видео: "Почему девочки лучше учатся в школе?"содержание
1. Свойства водыВода (оксид водорода) представляет собой химическое соединение , жидкое при стандартных условиях. Он также может находиться в газообразном состоянии в виде водяного пара или в твердом состоянии в виде льда. Термин «вода» как название химического соединения относится ко всем его состояниям из . Это основное неорганическое соединение , входящее в состав всех живых организмов. Свойства воды имеют большое и непосредственное влияние на функционирование каждого организма. Мы можем определить воду по формуле H₂O. Это отличный растворитель для полярных веществ . Подавляющее большинство его встречается на Земле в виде соли, т. е. содержит много растворенных солей (главным образом хлорида натрия). В естественной форме растворено атмосферных газов , из которых преобладает углекислый газ.Обычно перед использованием ее необходимо очищать, причем это касается как технической, так и питьевой воды. Это одно из самых распространенных химических веществ в природе. Оксид водорода — самый прочный оксид из всех аэробов. Онлайн-образование Онлайн-образование становится все более популярным.Компьютер — это не только рабочий инструмент, но и источник . читать статьюЧастица воды состоит из двух атомов водорода и одного атома кислорода. Благодаря полярному строению молекул воды между ними возможно образование водородных связей. Эти связи образуют пар по электронов, движущихся к атому кислорода. Угол между атомами, из которых состоит частица воды, составляет 105 градусов.Наличие углов и поляризованных связей между атомами обуславливает название молекулы воды , диполя . Частица воды имеет два полюса: отрицательный и положительный . Положительно заряженный находится со стороны атома кислорода, а отрицательно со стороны атома водорода. Слабые электростатические взаимодействия возникают между противоположно заряженными полюсами в частице воды. Образуются водородные связи, благодаря которым молекула воды имеет объемную и упорядоченную структуру. Благодаря водородным связям вода обладает определенными свойствами. Они:
Поверхностное натяжение представляет собой физическое явление, заключающееся в образовании сил при контакте жидкости с твердым телом , другой жидкостью или газом. В результате трудно погружать тела, невосприимчивые к этой жидкости. Высокая теплоемкость (количество тепла, которым система обменивается с окружающей средой при изменении температуры на 1 К) заставляет воду защищать клетки от резкого изменения температуры . Большое количество теплоты парообразования (количество энергии, необходимое для испарения единицы воды) используется организмом для предотвращения перегрева и охлаждения тела. Образование читать статью2.Биологическое значение воды 900 17Вода является обычным растворителем для соединений тела и необходимой пищевой добавкой для каждого известного организма. Он участвует в протекании большинства метаболических реакций, является средством внутрикорпорального транспорта (например, питательных веществ, ферментов, гормонов и продуктов метаболизма). Составляет от 60-70% массы взрослого человека (у новорожденных будет даже 85-90%). При этом его вода на 90% состоит из плазмы крови, на 90% из листьев, на 60-70% из лимфы, на 20% из костей.В 2008 году более миллиарда человек не имели доступа к питьевой воде. Из-за 90 019 нехватки чистой воды ежедневно умирает 90 020 человек, наибольшую группу из которых составляют дети. .Вода - виды и свойстваВода - источник жизни. Это основной компонент нашей планеты и большинства организмов, населяющих ее. С химической точки зрения это окись водорода, то есть популярная H3O. Молекула, содержащая всего три атома, обладает такими интересными и незаменимыми свойствами, что без нее жизнь на Земле в ее нынешнем состоянии не существовала бы. В то же время объяснение некоторых его свойств до сих пор остается сложной задачей, стоящей перед учеными.Вода также является основным ингредиентом (до 90%) многих продуктов — как пищевых, так и лекарственных и косметических, — с которыми мы соприкасаемся каждый день. Если вода H 2 O, в чем разница между минеральной, очищенной, дистиллированной или термальной водой? Водопроводная вода хуже минеральной? Каждый ли полезен для нас и можно ли отравиться водой? Сколько воды в день и как ее вводить в организм? Вода неравномерна по отношению к воде? Виды воды, с которыми мы сталкиваемся каждый деньВода в самой чистой форме представляет собой H 2 O, но получить чистое это вещество довольно сложно, поскольку вода является суперрастворителем.Поэтому любой вид воды, с которым мы имеем дело в повседневной жизни, на самом деле является водным раствором различных веществ. Без сомнения, водопроводная, минеральная и родниковая вода - самые популярные виды воды, с которыми мы сталкиваемся. Минеральные и весенние лепешки чаще всего продаются в бутылках. Оба типа забираются из подземных резервуаров, с той разницей, что минеральная вода забирается из более глубоких слоев земного покрова, чем родниковая вода.Они характеризуются содержанием минералов природного происхождения. Это означает, что эти воды содержат макро- и микроэлементы - ионы металлов (например, кальция, магния или натрия) и необходимые анионы (например, карбонаты или хлориды), попавшие в воду из пород, окружающих водозабор. Количество каждого вида ионов зависит от источника, из которого берется вода, поэтому воды бывают высокоминерализованные и слабоминерализованные. В соответствии с требованиями польского законодательства этикетка выбранной воды должна содержать состав с указанием содержания отдельных ионов, содержащихся в продукте. Газированная вода и столовая вода — это другие виды воды, изготовленные из минеральной и родниковой воды. Газированную воду дополнительно насыщают углекислым газом. Столовая вода, с другой стороны, может быть смесью глубинной воды и очищенной водопроводной воды, обогащенной выбранными минеральными солями. Водопроводная вода является еще одним популярным источником H 2 O в нашей повседневной жизни. Его можно получить из подземных (глубоководных) и наземных источников (из водоемов, таких как реки, озера или моря) или из очистных сооружений.Перед тем, как вода из каждого из вышеперечисленных источников поступит в систему водоснабжения, она должна быть подготовлена для потребления на станциях водоподготовки и водоподготовки. Он лишен химических и микробиологических загрязнений. Для этого используется ряд фильтров и методов химической обработки, таких как хлорирование или озонирование. Как и в случае с минеральными и родниковыми водами, надзорный орган (Госсанэпиднадзор) и его исполнительные органы контролируют качество сырья.Так что вода в водопроводе соответствует всем требованиям и ее можно пить без опаски. Следует, однако, помнить, что от станции до нашего крана он проходит долгий путь по трубам, состояние которых бывает разным и может влиять на его качество. Целебные воды из особых глубоководных источников, признанных целебными. В соответствии с Законом о геологической и горной промышленности лечебные воды характеризуются общим содержанием растворенных минералов не ниже 1000 мг/л.Их целебные свойства варьируются в зависимости от доли минералов. Что немаловажно, использовать этот вид поддержки нашего организма следует после консультации со специалистом. Очищенная вода - aqua purificata - является компонентом косметики и лекарств, и ее параметры описаны в документе под названием Польская Фармакопея . Его приемлемый химический и микробиологический состав точно определен. Очистка воды может осуществляться различными физико-химическими методами, поэтому под кодом очищенная вода мы можем найти, например.дистиллированная, деионизированная или осмотически очищенная вода. Этот тип воды чаще всего получают путем очистки водопроводной воды. В процессе дистилляции сырье нагревают до температуры кипения воды (100 o С) и затем конденсируют. Так как большинство растворенных в воде веществ имеют температуру кипения выше 100 на °С, дистиллированная вода лишена значительного количества веществ, растворенных в ней до процесса очистки. Однако не все они удаляются в процессе дистилляции, поэтому деионизация часто является дополнительным процессом очистки.Во время этой процедуры вода проходит через серию фильтров, в которых задерживаются растворенные в воде вещества. С другой стороны, осмотическая очистка использует явление обратного осмоса. Вода пропускается под повышенным давлением через специально сконструированные мембраны, задерживающие растворенные в ней вещества. Термальная вода и целлюлярная вода – препараты, предлагаемые в основном косметическими компаниями. Термальные воды являются глубоководными.По определению их температура при добыче должна быть выше среднегодовой температуры воздуха в данной местности. Как и минеральные и родниковые воды, их химический состав зависит от места добычи. Применяются как в оздоровительных целях (ванны в термальных водах), так и в косметических и косметических целях в качестве препаратов для увлажнения поверхности лица перед профессиональными процедурами и при домашнем уходе. Мы делим термальные воды на гипотонические, требующие дренирования через ок.30 секунд после нанесения и изотоник, который можно оставить на лице для самопроизвольного испарения. Клеточная вода – новинка на косметическом и косметологическом рынке. Он запатентован французской компанией, и его уникальность заключается в том, что, кроме H 2 O, он содержит идентичный составу ингредиентов нашей кожи, благодаря чему проявляет большую совместимость и усвояемость. Как пить воду, чтобы избежать обезвоживания организма, и можно ли пить слишком много?Наши потребности в воде варьируются в зависимости от возраста, образа жизни и состояния здоровья.Мы должны выпивать около 1,5-2 литров воды в день. Всю суточную дозу следует принимать небольшими порциями. Резкое превышение рекомендуемого количества может негативно сказаться на нашем здоровье. Состояние гипергидратации, т.е. чрезмерное разжижение жидкостей организма, может быть следствием употребления, например, большого количества маломинерализованной воды за короткое время (например, 4 литра за раз) или накопления воды в организме. из-за болезни - например, болезни почек. .Морская вода - свойства, растворы морской воды, применениеВы можете прочитать этот текст за 3 минуты Морская вода присутствует в морях и океанах, в ней растворены химические соединения и почти все химические элементы, встречающиеся на земном шаре.Морская вода составляет 97 процентов жидкой воды на поверхности Земли, в то время как пресная вода составляет менее 3 процентов. Морская вода содержит высокую концентрацию катионов натрия, калия, магния и кальция, а также анионов хлора, сульфата и карбоната, которые характеризуются сильно горьким или горько-соленым вкусом, что делает ее непригодной для питья. Тем не менее литр морской воды можно выпивать ежедневно без вреда для организма. ПонгсакорнДжун / iStockМорская вода имеет рН от 7,5 до 8,4. Морская вода очень хорошо впитывается кожей человека, так как состав воды аналогичен амниотической жидкости, в которой развивается плод, а концентрация минералов аналогична концентрации сыворотки крови человека. В результате минералы морской воды могут глубже проникать в поры кожи и очищать ее. Конечно, морская вода стимулирует клеточный метаболизм, благодаря чему кожа правильно увлажняется, лучше кровоснабжается, т.е. также окисляется и питается.Кожа становится более эластичной, можно рискнуть сказать, что происходит омоложение, но процесс должен длиться не менее 3 недель. Процедуру можно проводить с использованием косметических средств, содержащих воды морской . Однако не забывайте всегда входить в воду постепенно и тщательно мыть кожу после купания, потому что морская вода подсыхает на коже и способствует обезвоживанию и вместо помощи - будет вредна. Морская вода - растворыИспользуемые растворы Морская вода бывают изотоническими и гипертоническими в зависимости от концентрации NaCl.Гипертонический раствор, применяемый для ингаляций, усиливает мобилизацию секрета в нижних дыхательных путях за счет осмотического эффекта. Он не только увлажняет, но и очищает нос, а также проясняет его, уменьшая отек. Изотонический раствор за счет низкой концентрации солей очищает только носовую полость и увлажняет слизистые оболочки. Морская вода - применениеМорская вода является наиболее эффективным средством для очистки слизистой оболочки от загрязняющих веществ, таких как пыльца или микроорганизмы, и избыточных выделений.Вода увлажняет слизистую оболочку, обеспечивая минералами. Морская вода - насморкНасморк у детей раннего возраста – недуг, влияющий на жизнедеятельность ребенка – мешает повседневной жизнедеятельности, не дает свободно принимать пищу. Если не лечить насморк, он может привести к таким заболеваниям, как средний отит, бронхит, фарингит и другие респираторные инфекции. Независимо от вида насморка, будь то бактериальный, вирусный или аллергический, слизистая в носовых ходах отекает, что затрудняет или делает невозможным свободное дыхание через нос.Наиболее эффективным и безопасным средством от заложенности носа для детей и взрослых является морская вода . Лучшая морская вода содержит много элементов, таких как калий, селен, магний, железо, медь и сера, обладающих антисептическими и антибактериальными свойствами.
Кто об этом знает? - - Новости
Вода представляет собой химическое соединение, состоящее из двух атомов водорода и одного атома кислорода с формулой h3O. Атомная масса воды 18 мк Из-за электронной конфигурации кислорода вода не имеет линейной геометрии, ее молекула изогнута под углом 104°. Благодаря этому молекула воды постоянно поляризована: кислород, будучи более электроотрицательным, накапливает отрицательный заряд, а водород — положительный. Полярность молекул воды позволяет ей образовываться как в растворе, так и в твердом состоянии, образуя сеть поляризованных связей, называемых водородными связями.Эти связи ответственны за все физические и многие химические свойства воды. Это самое важное вещество на Земле, необходимое для существования любой формы жизни. Вода – бесцветное вещество без вкуса и запаха. В нормальных условиях это жидкость, которая затвердевает при 0°С при атмосферном давлении и кипит при 100°С. Вода — одно из немногих веществ, проявляющих в той или иной мере обратное тепловое расширение: при затвердевании при температуре 4—0°С вода, вместо того, чтобы сжиматься в объеме, расширяет его.Изменение объема при затвердевании воды достигает 10%, поэтому оно очень велико. Этот процесс можно легко наблюдать, поместив плотно наполненную бутылку с водой в морозильную камеру. В результате увеличения своего объема при замерзании вода разрывает бутылку. Подобный процесс вызывает крошение горных пород и образование почвы. Также благодаря этому свойству зимой водоемы промерзают не по всему объему, а только по поверхности. Поскольку лед менее плотный, чем вода, он остается на плаву (около 90 % льда находится ниже поверхности воды, а 10 % — над ней).Вот почему айсберг плавает на поверхности, а не тонет. Вода состоит из очень маленьких полярных молекул, что делает ее отличным растворителем для многих веществ. Когда вода проходит через почву, она растворяется и «забирает» с собой много минеральных солей, поэтому обычная вода содержит большое количество растворенных газов, взвесей и минеральных солей. Даже самые чистые родниковые воды содержат определенное количество растворенных веществ, главным образом карбонатов кальция и магния, которые являются наиболее распространенными минералами в почвах.Дождевая вода относительно чистая, но из-за возрастающего загрязнения воздуха в ней часто содержатся растворенные вредные вещества и даже серная кислота 9009 и азотная кислота . Самая чистая вода в природе – это арктическая ледниковая вода, но она также содержит некоторые растворенные минералы. Морская вода содержит некоторое количество NaCl и других легких металлов, что делает ее соленой. Процесс дистилляции используется для получения чистой воды без каких-либо растворенных веществ.Дистиллированная вода используется во многих областях: в фармацевтической промышленности, в химии (производственной и лабораторной), а также в аккумуляторах. Минеральный состав воды определяется ее жесткостью. В зависимости от промышленного применения жесткость воды должна соответствовать установленным стандартам. Например, вода, подвергающаяся воздействию высоких температур (питательная вода для котлов), должна быть полностью очищена от минеральных солей, особенно карбоната кальция, который вызывает так называемоеизвестковый налет и засорение труб, что может привести к взрыву. Кроме того, у камня очень низкая теплопроводность, поэтому стенки труб, покрытые камнем, очень плохо отдают тепло. Высокие требования предъявляются и к воде, используемой в текстильной промышленности (без солей тяжелых металлов), особенно к питьевой воде. Жесткость воды – показатель, определяющий содержание в воде растворенных соединений кальция, магния, железа и кремния. Это градуированная шкала - один французский градус означает 1 г карбоната кальция на 100 литров воды.В зависимости от того, какие соединения мы учитываем при определении твердости, различают: Ca (HCO3) 2 ® CaCO3 + h3O + CO2
Вода является самым распространенным химическим веществом на нашей планете - ее количество оценивается в 2,2´1018 тонн.Это значит, что если бы каждая тонна воды была размером с булавочную головку, она могла бы проложить дорогу от Земли до Луны шириной 10 км! Глядя на карту, сложно представить такое огромное количество воды. Благодаря тому, что воды в природе так много, и что она встречается практически везде: в морях, океанах, ледниках, в почве, в атмосфере, в живых организмах и т. д., она находится в определенном состоянии динамического равновесие. Происходящие изменения и процессы не нарушают это равновесие до такой степени, чтобы в какой-либо среде вдруг не хватило воды.Важнейшим процессом воды является испарение под воздействием солнечных лучей. С огромных поверхностей морей и океанов в атмосферу попадает много воды, но единовременно ее столько, что хватило бы всего на 10 дней дождя. Вода в атмосфере при благоприятных условиях (высокая влажность) конденсируется и группируется, образуя облака. Облака обладают способностью путешествовать с ветром на очень большие расстояния, благодаря чему вода из океанов может проходить над континентами и выпадать там в виде дождя или снега. Дождевая вода впитывается в почву и питает поверхностные воды. Однако большая его часть просачивается в землю, откуда поглощается многочисленными растениями, для которых является важным компонентом процесса фотосинтеза. Вода, которая просачивается глубже в почву, достигает непроницаемых слоев горных пород и создает грунтовые и глубинные воды. Проходя через почву, вода тщательно фильтруется и обогащается минералами, благодаря чему мы получаем очень чистые источники.Из этих источников мы берем питьевую воду в виде так называемой родниковая вода (слабоминерализованная) и минеральная вода (высокоминерализованная). Подземные воды также питают поверхностные воды, впадающие в моря и океаны, постоянно снабжая их водой. Таким образом круговорот воды в природе замыкается. То, что вода является таким уникальным веществом, определяется не только ее универсальностью, но и определенными физическими свойствами. Одним из них является очень высокая удельная теплоёмкость воды: чтобы поднять температуру 1 г воды на 1 °С, ей требуется 1 калория энергии.Теплота парообразования воды также очень велика: для испарения 1 г необходимо 540 калорий. По сравнению, например, с этиловым спиртом эти значения более чем в два раза больше. Перечисленные выше физические свойства делают климат в прибрежных районах значительно более теплым, чем во внутренних районах (вода зимой, остывая, отдает накопленное летом тепло). Высокая теплота парообразования также означает, что испарение и таяние замерзших рек и озер — это не насильственный процесс, а скорее мирный, позволяющий распространяться большому количеству выделяемой воды.Благодаря этому не бывает внезапных заторов воды и постоянных весенних паводков. Высокая теплота парообразования воды также используется организмом для поддержания постоянной температуры в периоды перегрева. Вода из организма выделяется через кожу в виде пота, а затем испаряется, она испаряется, что требует от тела большого количества тепла. Это охлаждает тело и поддерживает теплую кровь. Вода представляет собой химическое соединение, имеющее фундаментальное биологическое значение.Из многих химических веществ, которые строят клетки, воды больше всего. Его доля в структуре тела всех живых организмов больше, чем других веществ: она колеблется в зависимости от организма от 70 до 90%. Медузы содержат больше всего воды - около 98%, а меньше всего костной ткани (около 20%), семян (менее 15%) и клеточных стенок растений (менее 10%). Биологическая роль воды заключается в создании жидкостей организма, регулировании температуры тела, осмотического давления и реакции (pH) и участии во многих метаболических процессах.Благодаря воде возможен внутрикорпоральный транспорт, а также выведение ненужных продуктов метаболизма и вредных веществ. Одной из важнейших функций воды в организме является регуляция осмотического давления. Осмотическое давление – это определенная величина, которая позволяет поддерживать баланс между внутренней частью клетки и жидкостями организма. Системный баланс основан на возникновении равных осмотических давлений между внутренней частью клетки и внешним раствором. В этих условиях вода не может проникнуть в клетки или выйти из них, сохраняя таким образом форму и размер клетки.Раствор, находящийся в равновесии с клеткой, называется изотоническим. Примером такого раствора является плазмы крови. В том случае, если осмотическое давление раствора, окружающего клетку, ниже, т. е. раствор содержит менее клеток, растворенных веществ, клетка набухает до выравнивания осмотического давления. Мы называем такие растворы гипотоническими. С другой стороны, гипертонические растворы — это растворы, содержащие больше растворенных веществ, чем клетка.Они заставляют клетку сокращаться до тех пор, пока осмотическое давление не выровняется. Явление сморщивания и набухания клеток под влиянием колебаний осмотического давления очень хорошо видно на примере растений. В условиях водного дефицита жидкости организма сгущаются, а клетки сморщиваются, чтобы выровнять осмотическое давление — это явление увядания растений. Добавление воды заставляет клетки расслабляться, и растение возвращается в нормальное состояние. Феномен осмотического давления можно наблюдать в домашних условиях, проведя простой эксперимент.Поместите сырое куриное яйцо в сосуд с уксусом и оставьте на 24 часа. Уксус (уксусная кислота) разрушает скорлупу, поэтому яйцо защищено только тонкой пленкой. После выливания уксуса из сосуда и помещения яйца в воду яйцо набухает до размеров гусиного яйца. Когда вы достаете яйцо из воды и помещаете его в концентрированный раствор поваренной соли, происходит обратный процесс — яйцо сморщивается. Оба явления (набухание и сморщивание яйца) являются результатом осмоса через оболочку яйца.Через мембрану могут пройти только мелкие частицы воды, а частицы белка слишком велики. Вода в результате осмотического давления проникает в сторону большей концентрации минеральных соединений. Вторая важная роль воды заключается в выведении из организма продуктов жизнедеятельности и вредных веществ. Выведение происходит с мочой. Мочеиспускание вызывает значительную потерю воды в организме: в среднем взрослый человек выделяет от 0,6 до 2,5 л воды в сутки.Нехватку воды необходимо постоянно восполнять, выпивая достаточное количество жидкости и употребляя в пищу продукты, содержащие большое количество воды. Воду получают окислением водорода. Реакция записывается следующим образом: 2h3 + O2 ® 2h3O Окисление водорода является сильно экзотермической реакцией с выделением большого количества тепла. Поэтому вода — очень стабильное соединение: для диссоциации ее молекул нужна температура около 1800К.Тем не менее, вода является довольно реакционноспособным веществом. Он реагирует, например, с некоторыми металлами (например, Na, K, Ca) с образованием гидроксидов с выделением водорода. Кроме того, он обладает высокими сольватирующими способностями и прикрепляется различными соединениями. По характеру воды в химических соединениях различают:
Ca(OH) 2 ® CaO + h3O
Эти свойства делают воду таким необычным веществом. Еще одной важной особенностью воды как растворителя является то, что она не растворяет соединения с неполярными молекулами. Мы говорим, что такие соединения являются гидрофобными. Это явление очень хорошо видно на примере масла, смешанного с уксусом. Эта смесь при добавлении в воду разделяется: полярная уксусная кислота растворяется в воде, а длинные неполярные частицы жира оседают на поверхности в виде отдельной фазы.Вода и уксусная кислота, помимо того, что являются полярными жидкостями, имеют очень близкие молекулярные размеры. Поэтому они бесконечно перемешаны друг с другом: мы можем иметь и уксусную кислоту в воде, и воду в уксусной кислоте. Мы говорим, что вода и уксусная кислота образуют гомогенный раствор с неограниченной растворимостью. С другой стороны, длинная неполярная цепь жира не может быть растворена водой, поэтому жир обычно скапливается на поверхности раствора, образуя отдельную фазу. Вопреки видимому, нерастворимость жиров в воде не является результатом отсутствия электростатического притяжения между молекулами воды и жира или очень слабого притяжения.Более того, вода притягивает жир сильнее, чем частицы жира притягиваются друг к другу. Это явление хорошо видно, если капнуть каплю масла в сосуд с водой. Частицы масла притягиваются друг к другу, поэтому для минимизации энергии они создают в воздухе наименьшую форму поверхности — шар. В результате лишь небольшое количество частиц жира не полностью окружено другими частицами. Когда капля падает в сосуд с водой, жир растекается по поверхности, образуя тонкий ровный слой.Если бы молекулы воды не притягивали жир, капля воды по-прежнему имела бы форму шара. Формирование ровного слоя означает, что молекулы воды сильнее взаимодействуют с молекулами жира и заставляют шарик «разворачивать» поверхность. Вопрос: если молекулы воды и масла так сильно взаимодействуют, то почему масло не растворяется в воде? Ответ очень прост: образуя тонкий слой на поверхности, молекулы нефти взаимодействуют только с теми молекулами воды, которые в данный момент находятся на поверхности.Это молекулы, которые не полностью окружены другими молекулами и поэтому обладают способностью взаимодействовать с жиром. Молекулы воды, полностью окруженные другими молекулами воды и связанными с ними водородными связями, не взаимодействуют с жиром, потому что связь вода-вода намного прочнее, чем связь вода-жир. Следовательно, у молекул жира слишком мало сил, чтобы разорвать их на части. Таким образом, сильным является только взаимодействие между поверхностью воды и слоем частиц жира. Описанное выше явление используется для создания тонких мономолекулярных слоев жира на поверхности воды.Измеряя площадь поверхности слоя, можно получить информацию о приблизительном размере частиц масла, если мы знаем количество частиц, образующих слой (которое очень просто рассчитать, зная вес масла, молекулярная масса масла и число Авогадро). Еще одно интересное явление, связанное с водой, — катание на коньках. Это явление часто объясняют тем, что под действием давления температура плавления льда снижается, что значительно снижает трение между коньком и поверхностью льда.Это соответствует правилу неповиновения Ле Шателье, согласно которому система противодействует изменениям параметров: возрастающее давление компенсируется таянием части льда и уменьшением его объема. Однако этот эффект очень мал — чтобы понизить температуру плавления льда на 1 °С, необходимо давление аж в 121 атмосферу. Трудно представить, что фигурист весом около 75 кг сможет оказывать такое колоссальное давление на поверхность льда. Действительно, простые расчеты позволяют сделать вывод, что фигурист способен оказывать на лед давление около 12 атмосфер, что слишком мало для существенного изменения температуры плавления.Максимум, чего можно добиться, это падение температуры плавления на несколько десятых долей градуса Цельсия. Поэтому недостаточно снизить трение на поверхности конькобежца до такой степени, чтобы можно было кататься так быстро. Тем более, что всем известно, что гораздо лучше кататься по сильно промерзшему, припайному льду, температура которого значительно ниже точки плавления. Лед при температурах, близких к нулю, обладает гораздо большим сопротивлением. Так что хорошо видно, что приведенный выше перевод не очень возможен.Вышеописанный эффект намного слабее, чем эффект трения - тепло, выделяемое трением на границе конек-лед, может расплавить небольшой слой льда и значительно уменьшить трение. Однако наиболее полно объясняет это явление так называемое поверхностное таяние льда. Лед - кристаллическое вещество - это молекулы воды, расположенные в определенной кристаллической решетке. Прочность такой структуры является результатом взаимодействия между взаимно окружающими молекулами, взаимодействие которых позволяет сохранить структуру.Однако одна конкретная часть такого кристалла — поверхность — имеет другую структуру. Частицы на поверхности не полностью окружены другими частицами и поэтому гораздо меньше взаимодействуют с кристаллом. Это вызывает нарушения их положения, разрыв молекул с целью достижения расположения с наименьшей энергией — наиболее устойчивого. Это явление называется реконструкцией поверхности. Дезорганизация такой поверхности и ее движение приводит к тому, что она имеет свойства, очень похожие на свойства жидкости, даже при температурах значительно ниже точки плавления.Это явление называется поверхностным плавлением. Это явление значительно снижает трение, поэтому на льду легко скользить не только на коньках, но и с гораздо большей площадью поверхности. Другим интересным явлением, являющимся результатом замечательных свойств воды, является повышение температуры кипения при добавлении в нее поваренной соли. Наверняка все замечали, что добавление соли в кипящий картофель приводит к временной остановке приготовления. Еще лучше это явление можно показать, проделав очень простой эксперимент: стакан с чистой водой нужно поместить в кастрюлю с подсоленной водой, чтобы две жидкости не смешивались.Если нагреть такую кастрюлю, то сначала будет наблюдаться кипение воды в стакане, и только через мгновение закипит подсоленная вода. Однако эффект повышения температуры кипения от добавления соли незначителен, и в какой-то момент он перестает увеличиваться. Например, добавление небольшого количества соли имеет (макроскопически, т.е. как мы это наблюдаем) почти такой же эффект, как добавление очень большого количества соли. Повышение температуры кипения составляет около 0,6%, поэтому наблюдать такие незначительные изменения в «домашних» условиях очень сложно и кажется, что вне зависимости от количества соли эффект одинаков. Одно из возможных объяснений этого состоит в том, что точка кипения раствора зависит от концентрации нелетучего растворенного вещества в растворе. Как известно, кипение вещества есть состояние равновесия давления паров раствора и внешнего давления, которое чаще всего примерно равно атмосферному давлению, оказывающему давление на поверхность жидкости. В свою очередь, равновесное давление паров раствора определяет давление паров чистого растворителя при данной температуре.В таком состоянии динамического равновесия происходит быстрое образование пузырьков во всем объеме жидкости и их подъем к поверхности раствора. Наличие молекул нелетучих веществ может привести к тому, что молекулы растворителя (воды) будут сильнее притягиваться к поверхности, а значит, их испарение будет значительно меньше. Поэтому для того, чтобы давление паров растворителя было равно внешнему давлению, нужна более высокая температура, т. е. повышается температура кипения. Приведенный выше перевод дает наглядное представление о рассматриваемом явлении. Однако на самом деле влияние температуры кипения при добавлении хлорида натрия связано с другим вопросом. Как известно, NaCl является ионным соединением. После растворения в воде ионы Na+ и Cl- очень сильно сольватируются полярными молекулами воды. Сольватация намного сильнее, чем прочность взаимного связывания молекул воды. Следовательно, ионов на поверхности раствора нет, так как они не были бы там полностью сольватированы и поэтому имели бы неблагоприятно высокую энергию.Поверхность раствора поваренной соли представляет собой чистую воду. Таким образом, объяснение, что молекулы растворенного вещества, скапливающиеся на поверхности, препятствуют испарению растворителя, не соответствует действительности. Более того, казалось бы, большие молекулы растворенного нелетучего вещества вызывают большее повышение температуры кипения, так как могут эффективнее ингибировать испарение растворителя. Однако простые эксперименты и физико-химические расчеты показывают, что размер молекул растворенного вещества не влияет на повышение температуры кипения.Важно лишь то, каково отношение числа частиц растворенного вещества к числу частиц растворителя. Физико-химические исследования воды - для чего они нужны и что стоит проверять?Питьевая вода должна соответствовать строгим бактериологическим и физико-химическим требованиям. Почему стоит проводить физико-химический анализ воды? Тестирование воды – каково его применение?
Питьевая вода должна соответствовать строгим бактериологическим и физико-химическим требованиям. При этом все процессы, которые осуществляются, от источника до места получения, направлены на получение и поддержание его качества.Осуществляется контроль за забором воды из поверхностных и глубинных водозаборов. Для небольших водозаборов воду следует проверять не реже двух раз в год в рамках контрольного мониторинга и один раз в два года в рамках контрольного мониторинга. Индивидуальным клиентам рекомендуется проводить анализ питьевой воды не реже одного раза в год. Подробнее об этом читайте в нашем посте: Как часто вы тестируете воду?
Вода питьевая, безопасная для здоровья человека, - вода, свободная от патогенных микроорганизмов и паразитов (в количестве, которое потенциально может представлять опасность для здоровья человека), свободная от каких-либо веществ в концентрациях, которые могут представлять опасность для здоровья человека, отвечающая основным микробиологическим и физико-химические требования в соответствии с применимыми правовыми нормами.Подробнее по этой теме: https://envirlab.pl/baza-wiedzy/jakie-badanie-wybrac/ Кроме того, рекомендуется, чтобы используемая вода не обладала агрессивными коррозионными свойствами. Предполагалось, что микробиологические показатели относятся к санитарно-гигиенической безопасности, а физико-химические – в основном к содержанию химических веществ в воде.
Информация о регулярной проверке воды и информация о ее результатах позволяет потребителю принимать взвешенные решения о назначении воды и беречь собственное здоровье.
Физико-химические исследования воды и их значение
К физико-химическим испытаниям воды относятся не только определение вредных для здоровья веществ, таких как свинец, кадмий, ртуть, хром, органические вещества или тригалометаны, но и веществ, которые могут оказывать существенное влияние на установку, подающую воду от водозабора к место использования, например, смеситель на кухне.
Важно, чтобы вода, поступающая из известных действующих скважин, имела постоянный и стабильный состав.На практике загрязнения такой воды особо опасными веществами не происходит, потому что загрязнение не происходит ни в воде, ни в окружающей среде. Их появление указывает на внешнюю проблему, например, загрязнение окружающей среды, всасывание или сбой. Следовательно, в стандартных тестах проверяется наличие выбранных ингредиентов, обнаружение которых на уровне, превышающем допустимые стандарты, указывает на загрязнение и побуждает к детальным тестам. Предложение лаборатории Envirlab включает в себя подробную информацию как о тестовых пакетах, так и об отдельных параметрах/показателях, которые необходимо определять в воде - Тестовые пакеты - Вода
Какое значение физико-химических исследований воды для потребителя? Прежде всего, это сведения о пригодности воды для потребления, сведения об уровне встречаемости отдельных компонентов и, наконец, о загрязнении воды.В предыдущих статьях мы писали о частоте тестирования воды, а также о ключевых органолептических изменениях, которые должны обратить наше внимание на то, что вода может оказаться непригодной для употребления.
Итак, качество воды и ее пригодность к употреблению определяются микробиологическими и органолептическими показателями (приемлемыми для потребителя) - вкусом и запахом. В свою очередь анализируют следующие физико-химические показатели: цветность, мутность, рН, проводимость, ион аммония, нитраты, нитриты, марганец, железо, свободный хлор, тяжелые металлы (хром, мышьяк, кадмий, свинец) и побочные продукты дезинфекции.
В лаборатории Envirlab заказчик может сам решить, какой параметр он хочет проверить, выбрав его из доступного пакета или создав собственный тестовый пакет.
Физико-химические исследования воды – что стоит проверять?
Как было сказано выше, физико-химическое исследование воды состоит из ряда анализов, объем которых указан в соответствующих нормативных документах. Стоит обратить внимание на тип тестируемой воды и ее назначение, так как область применения питьевой воды отличается от тестирования «сырой» воды из подземных водозаборов.Таким образом, тестирование водопроводной воды включает в себя: цвет, мутность, запах, вкус, электропроводность, рН, концентрацию аммония, нитритов и нитратов, содержание железа и марганца, общую жесткость. В случае с подземными водами, кроме указанных выше, определяют содержание хлоридов, сульфатов или окисление с KMnO 4 . Вкус и запах воды, характерный для типа водозабора, напрямую связан с природными и биологическими процессами и источниками. Это также может свидетельствовать о химическом загрязнении.Следовательно, изменение вкуса воды по сравнению с текущим, когда вы чувствуете, например, послевкусие соленой, кислой, горькой, сладкой или металлической воды, должно быть сигналом потенциальной угрозы. Появление неприятного запаха, например растительного, землистого, травяного, цветочного, торфяного, гнилостного, затхлого, гнилостного, сероводородного, фекального, фенольного, рыбного, керосинового, бензинового или любого другого специфического запаха, ранее не появлявшегося первый ключ к действию. В свою очередь, обесцвечивание воды может быть следствием присутствия окрашенных органических веществ, металлов, в том числе железа, встречающихся как природные загрязнители воды или как продукты коррозии, свидетельствующие о проблемах с системой водоснабжения, или, наконец, о загрязнении сточными водами.Следует подчеркнуть, что вода с высокой мутностью, обусловленной наличием мелких твердых частиц, является очень хорошей средой для роста бактерий, и рекомендуется поддерживать этот параметр как можно ниже, чтобы не ухудшалось микробиологическое качество воды. . рН воды важен в основном для состояния системы водоснабжения и для самих процессов очистки или дезинфекции. Электропроводность воды связана с ее соленостью и жесткостью. В случае последнего параметра о жесткой воде свидетельствует наличие отложений на арматуре, бытовых приборах, более низкая эффективность водопроводной установки, пересыхание эпидермиса или более жирные волосы.Соединения азота в воде (в виде аммония, нитратов и нитритов) часто рассматриваются вместе из-за превращения одного в другое в результате реакций окисления и восстановления. Эти соединения могут поступать из почвы, где был вырыт колодец, или при наличии водозабора, например, с сельскохозяйственных угодий, где почва была удобрена азотными удобрениями. Во втором случае они могут исходить от т.н. вторичное загрязнение в результате попадания нечистот в почву и воду. Что должно обратить наше внимание на повышенное содержание железа и марганца в воде? Ну а употребление железосодержащей воды в количествах выше 0,3 мг/л (норматив 0,2 мг/л = 200 мкг/л) вызывает появление пятен на сантехнических приборах, на выстиранном белье, к тому же в процессе приготовления пищи вода может изменять свои физические свойства и влияют на вкус еды.Если вода содержит повышенное количество железа, в системе могут размножаться бактерии. Тогда мы наблюдаем не только повышенный цвет воды и ее помутнение, но и появление неприятного вкуса и запаха, а установки теряют работоспособность из-за засорения массами живых и умирающих бактерий. В случае с марганцем даже в водах с низким содержанием марганца могут размножаться бактерии, придающие ей неприятный затхлый запах, а в установках образующие биопленку. Железо и марганец встречаются как естественные компоненты поверхностных и глубинных вод, но источником железа также могут быть промышленные сточные воды или коррозия вод и сооружений, способствующие значительному загрязнению воды и снижению ее качества.
Приведенные выше примеры изменений, вызванных ухудшением качества воды по органолептическим и физико-химическим показателям, должны стать для нас сигналом к тому, чтобы взглянуть на эту среду, посоветоваться, что делать, чтобы убедиться, что используемая вода безопасно. Для этого ознакомьтесь с другими статьями, написанными сотрудниками Envirlab, на странице нашей базы знаний: https://envirlab.pl/база знаний/ и для прямого контакта с командой экспертов: https://envirlab.pl/kontakt/ . Вода – Физические свойства – ПрочееВода обладает несколькими важными физическими свойствами. Хотя известно, что эти свойства присущи воде повсеместно, большинство физических свойств воды весьма необычны. Учитывая низкую молекулярную массу этой формы молекул, вода имеет удивительно высокие значения вязкости, поверхностного натяжения, теплоты испарения и энтропии испарения, и все это можно отнести к обширному взаимодействию водородных связей, обнаруженному в жидкой воде.Открытая структура льда, обеспечивающая максимальные водородные связи, объясняет, почему твердая вода менее плотна, чем жидкая вода — очень необычная ситуация среди обычных веществ.
Химические свойстваВода подвергается различным химическим реакциям.Одним из важнейших химических свойств воды является ее способность вести себя и как кислота (донор протонов), и как основание (акцептор протонов), что характерно для амфотерных веществ. Наиболее ярко такое поведение проявляется при автоионизации воды: H два O (ж) + H два O (ж) H 3 OR + (водн.) + OH - (водн.) , где (l) представляет собой жидкое состояние, (aq) указывает на то, что соединения растворены в воде, а двойные стрелки указывают на то, что реакция может протекать в любом направлении и существуют условия равновесия.При 25 °C (77 °F) концентрация гидратированного H + (т. е. H 3 ИЛИ + , известного как ион гидроксония) в воде составляет 1,0 × 10 –7 M, где M это число молей на литр. Из одного иона ОН - образуется на каждый ион Н 3 ИЛИ + , концентрация ОН - при 25°С также составляет 1,0×10 -7 М. В воде при 25°С Н 3 Концентрация OR + и концентрация OH - всегда должны быть 1,0 × 10 -14 : [H + ] [O - ] = 1,0 × 10 + 14 , где [ ] — концентрация гидратированных ионов H + в молях на литр, а [OH — ] — концентрация ионов OH — в молях на литр. Когда кислота (вещество, которое может образовывать ионы H + ) растворяется в воде, и кислота, и вода выделяют в раствор ионы H + . Это приводит к ситуации, когда концентрация H + больше 1,0 × 10 -7 M. Поскольку всегда должно быть верно, что [H + ] [O - ] = 1,0 × 10 -14 при 25°С [OH -] следует понизить до некоторого значения ниже 1,0×10 -7 . Механизм снижения концентрации ОН - включает реакцию Н + + ОН - → Н двух ЛУБ, которая происходит в той мере, в какой это необходимо для восстановления продукта [Н + ] и [ОН - ] до 1,0×10 -14 М.Так, при добавлении кислоты к воде полученный раствор содержит больше Н + , чем ОН - ; то есть [H + ]> [OH - ]. Такой раствор (где [H + ] > [OH - ]) считается кислым. Наиболее распространенным методом определения кислотности раствора является его pH, который определяется через концентрацию ионов водорода: pH = −log [H + ], где логарифмический символ представляет основание-10 логарифм. В чистой воде, в которой [Н + ] = 1,0×10 -7 М, рН = 7,0.Для кислого раствора pH меньше 7. Когда основание (вещество, действующее как акцептор протонов) растворяется в воде, H + концентрация уменьшается так, что [OH - ] > [H + ]. Щелочной раствор характеризуется рН>7. Таким образом, в водных растворах при 25 °С:
Окислительно-восстановительные реакцииКогда активный металл, такой как натрий, контактирует с жидкой водой, происходит бурная экзотермическая (выделяющая тепло) реакция с выделением горящего газообразного водорода.2Na (у) + 2H два O (ж) → 2Na + (вода) + 2OH - (водн.) + H два (г) Это пример окислительно-восстановительной реакции, т.е. реакция, при которой электроны переходят от одного атома к другому. В этом случае электроны передаются от атомов натрия (образуя ионы Na + ) к молекулам воды с образованием газообразного водорода и ионов OH - . Аналогичные реакции с водой имеют и другие щелочные металлы. Менее активные металлы медленно реагируют с водой. Например, железо медленно реагирует с жидкой водой, но намного быстрее реагирует с перегретым паром с образованием оксида железа и водорода.
Драгоценные металлы, такие как золото и серебро, вообще не вступают в реакцию с водой. .90,000 13 фактов о воде, которых вы, возможно, не знаете - Crazy ScienceКазалось бы, на Земле нет ничего более распространенного, чем вода. Ну нет, ведь на самом деле вода — одно из самых странных веществ в природе. Вода — одно из самых распространенных веществ в природе, но также и одно из самых странных химических веществ. Это одно из немногих веществ, которые могут существовать в трех агрегатных состояниях: твердом, жидком и газообразном — и они сосуществуют друг с другом при типичных земных температурах. Много и мало одновременно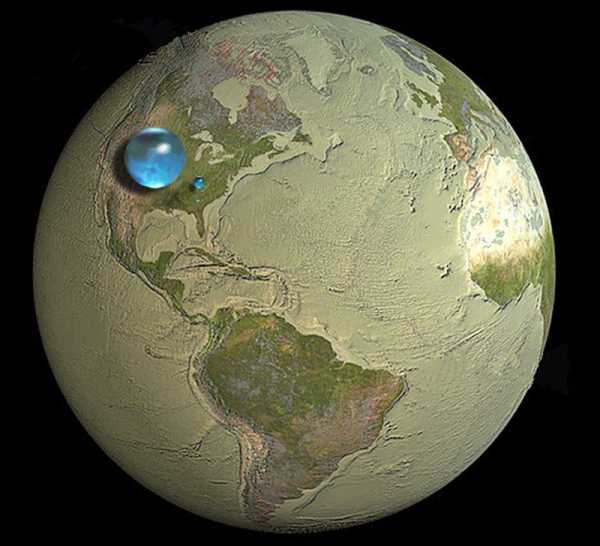 Если бы всю воду на Земле собрать в каплю, шар имел бы диаметр около 1500 км. Меньшая капля — это вода, застрявшая в ледяных шапках, а самая маленькая капля — пресная вода. На поверхности Земли находится примерно 1,5 миллиарда кубических километров воды. В пересчете на бессмертные олимпийские пулы это будет около 800 трлн таких пулов. Много. Только 97 процентов. из которых составляет соленая вода, и чуть более 2% аккумулированы ледяные шапки у полюсов. вода. Так, на пресную воду в жидком состоянии приходится лишь менее 1 процента. всех ресурсов этого вещества в мире. Нам повезло, что мы можем использовать его столько, сколько захотим. Не все на нашем земном шаре такие. Другой источник воды, вероятно, находится в мантии Земли и, возможно, больше, чем на поверхности. Экосфера - исключительное совпадениеТот факт, что мы вообще живем на Земле, обусловлен стечением благоприятных обстоятельств.Нашей планете повезло оказаться в обитаемой зоне, то есть зоне вокруг звезды, где температура находится в пределах от -70 до +80°С. В экосфере необходимо наличие жидкой воды на поверхности и свободного кислорода в атмосфере. Для этого был бы рекомендован магнитный экран для защиты от вредного для живых организмов космического излучения. Земля идеально соответствует этим условиям . Обитаемая зона в Солнечной системе также включает Венеру и Марс, которые, как подозревают астробиологи, когда-то могли быть преобладающими условиями для жизни. Астрономы обнаружили твердые планеты в местах обитания и за пределами Солнечной системы. В настоящее время самым мощным кандидатом на роль сестры-близнеца Земли является открытая в 2015 году планета, носящая невыразимое имя Kepler-452b. Это 60 процентов. больше Земли и получает 10 процентов от своей звезды. больше энергии, чем наша планета от солнца, поэтому если на ней есть вода, то она может существовать в жидком состоянии. Где в Солнечной системе больше всего воды? Где в Солнечной системе можно найти жидкую воду? Хотя вода покрывает более 70%поверхность нашей планеты Земля вовсе не водная сила в Солнечной системе . Ученые подсчитали, что на Европе, , одном из спутников Юпитера, воды более чем в два раза больше, чем на нашей планете. В свою очередь, Титан , самый большой спутник Сатурна, имеет почти в 11 раз больше, чем Земля. Эти расчеты сделаны с учетом средней глубины океанов: 4 км на Земле, 100 км в Европе и 200 км на Титане. Ледяные шапки Титана и Европы не учитывались. Самая большая масса воды во Вселенной Квазар питает сверхмассивную черную дыру. Источник: Кредит: НАСА / ЕКА Крупнейшее и старейшее скопление воды в известном космосе ученые обнаружили в квазаре, окруженном сверхмассивной черной дырой в 12 миллиардах световых лет от Земли. Там вода находится в виде водяного пара, и ее объем оценивается в 140 триллионов больше, чем объем всех земных океанов . Это означает, что вода присутствовала во Вселенной практически с самого начала ее существования. Универсальный растворитель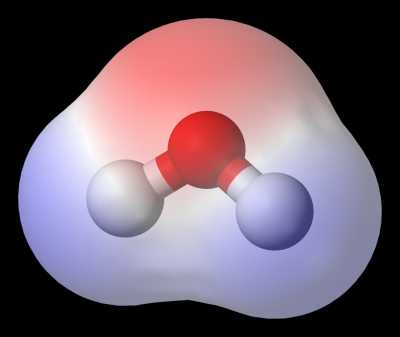 Схема строения молекулы воды (h3O). Источник: Викимедиа .В молекуле воды (h3O) два атома водорода немного смещены по отношению к атому кислорода (угол наклона ок. 105 градусов). В результате эта молекула имеет неравномерно распределенный электрический заряд и поэтому легко разрывает связи других полярных веществ (таких как этиловый спирт) и ионных (таких как каменная соль). Вода не плохо растворяет вещества органического происхождения, но хорошо справляется с минералами.Вот почему, просачиваясь сквозь подземные слои горных пород, она насыщается содержащимися в них минералами. Его путешествие по пористым породам может занять до нескольких сотен лет, в результате чего образуется минеральная вода. Транспортировка внутри кузоваВода приносит в организм много питательных веществ, включая углеводы, витамины и минералы. Кроме того, в живых организмах вода участвует в широко известном транспорте как компонент крови, лимфы или растительного клеточного сока. Вода является основным компонентом объема человеческого тела Сколько воды в человеке? Фото всецветные / Flickr Должен быть газомпри комнатной температуреВещества с такой же молекулярной массой, как у воды, являются газами при комнатной температуре. Так обстоит дело, например, с кислородом или сероводородом. Но не вода. Почему? Причиной этого является особый тип химической связи внутри молекулы воды. Атом водорода очень слабо связывается с электронами атома кислорода соседней молекулы воды.Прочность такой связи составляет всего около 5 процентов. сила обычных привязок. В результате каждая молекула воды так или иначе «прилипает» к другим молекулам (с которыми вода чрезвычайно охотно связывается), а значит, эффективная молекулярная масса значительно больше «уставной» 18. Поэтому при комнатной температуре вода остается жидкость. И при той же температуре может существовать и в виде газа, т.е. водяного пара, что само по себе необычно. Испаряется при любой температуре на ЗемлеИспаряется не только вода, но и снег и лед даже при температуре ниже 0 градусов Цельсия.C, который затем называется сублимацией. Поведение, несовместимое с законами физики Рис. Скиз / Pixabay Свойства воды как жидкости не всегда подчиняются основным законам физики. Аномалия - тепловое расширение . Большинство жидкостей густеют при понижении температуры. Но не вода. Наибольшей плотности она достигает при температуре около 4 градусов С, а в интервале от 4 градусов С до 0 градусов С происходит обратный процесс - вода теряет свою плотность. Благодаря этому лед не тонет, а только плавает на его поверхности.Это имеет большое значение для существования жизни, так как предотвращает промерзание резервуаров до дна. Благодаря тому, что вода на дне имеет наибольшую плотность и дольше сохраняет тепло, водные животные могут пережить морозы под слоем льда. Лед легче водыСпецифическая структура молекулы воды приводит к тому, что при температуре ниже 0 градусов С она связывается с четырьмя другими молекулами воды. Таким образом, лед приобретает пространственную структуру, подобную кристаллам .Полученная кристаллическая решетка напоминает соединенные полые туннели. По этой причине объем льда намного больше объема воды. Интересен тот факт, что существует как минимум 16 фаз, или типов льда, и каждая из них имеет различную кристаллическую структуру. Сила поверхностного натяжения Рис. Брокен Инаглори / Wikimedia Из-за образования водородных связей между молекулами вода имеет чрезвычайно высокое поверхностное натяжение .Поэтому он стремится минимизировать поверхность своего контакта с воздухом, создавая, в том числе, сферические капли. Следствием этого является, например, мениск на поверхности судна или возможность движения лыж по поверхности воды. Откуда берется вода на Земле?До недавнего времени ученые были убеждены, что вода попала на Землю вместе с кометами , поразившими ее во время Великой бомбардировки между 3,8 и 4,1 миллиарда лет назад. Чтобы проверить это, Европейское космическое агентство направило к комете 67P/Чурюмова-Герасименко зонды Rosetta и Philae. Данные, отправленные на Землю, показали, что лед, из которого состоит эта комета, содержит воду с другим изотопным составом, чем вода на нашей планете. Таким образом, это подрывает идею о том, что вода на Земле происходит от комет. В настоящее время ученые проверяют концепцию о том, что на нашем земном шаре на момент его образования могло существовать воды, или образовались в результате переноса солнечным ветром на Землю атомов водорода, которые вступали в реакцию с кислородом. Что вы искали у нас?. |